 400-028-6288
400-028-6288 在线客服
在线客服
 官方微信
官方微信
 400-028-6288
400-028-6288 在线客服
在线客服
 官方微信
官方微信

新闻动态
“中位PFS 39.1月vs 5.6月 HR 0.16”。
ASCO全体大会上迎来了今年的起立掌声。
LAURA研究补上了奥希替尼在早期术后辅助、晚期一线及后线治疗之后,EGFR突变NSCLC上的 后一块拼图,一起来速览研究结果。
奥希替尼对比安慰剂用于III期EGFR突变NSCLC根治性放化疗后巩固治疗的随机、双盲、多中心3期研究。
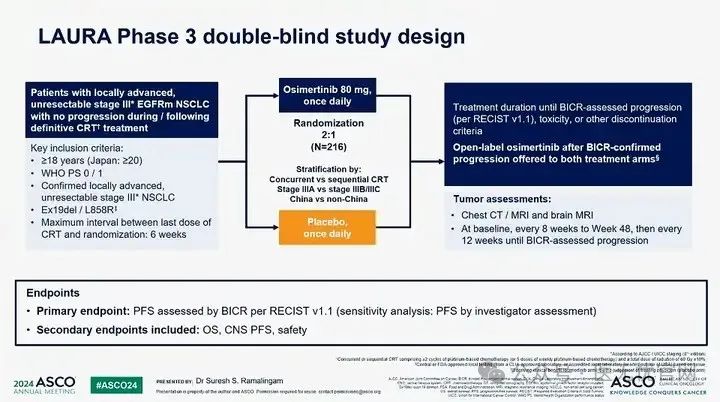
研究设计
LAURA研究设计
局部进展、不可切除III期NSCLC患者,经本地或中心检测EGFR突变阳性(包括Ex19del或L858R),在经过标准根治性放化疗后无进展,216例患者经2:1随机,对比奥希替尼或安慰剂,治疗直至BICR评估疾病进展或其他停药标准。
研究终点:主要终点为BICR评估的PFS,研究者评估PFS作为敏感性分析;次要终点包括OS, CNS的PFS以及安全性等。
分层因素:放疗选择同步vs序贯;肿瘤分期IIIAvs IIIB/IIIC期;地区:中国/非中国;
对照组设置:研究选择安慰剂对照,考虑到PACIFIC研究回顾性分析,度伐利尤单抗巩固治疗在EGFR突变患者中疗效低于野生型患者。
进展后治疗:可交叉设计。对照组/试验组经BICR确认进展可接受开放标签的奥希替尼治疗。
数据截止日期:2024年1月5日。
研究预设的PFS HR为0.53 ,90%的把握度将PFS从8.0月提升到15.0月,双侧显著性水平5%。
检验顺序采用序贯的多重性检验策略,依次检验PFS,OS和CNS的PFS。
OS在PFS主要分析时检验,OS的 终分析会在达到60%成熟度时进行。
截至数据截止日期,试验组和对照组分别有44%和90%的患者终止治疗。
试验组和对照组中位的PFS随访时间分别为22.0月和5.6月。
进展后接受奥希替尼治疗的比例:对照组 81%(50/62) 患者接受交叉治疗。试验组28%(15/53) 进展后继续接受奥希替尼治疗。
患者基线特征
地区人群:亚洲人群在两组分别占到81%和85%。其中中国患者占总体18.5%(40/216)。
疾病分期:IIB/IIIC期占到2/3 左右, 在两组分别占64%,67%。
放疗选择:大部分患者接受同步而非序贯放化疗,同步占比分别为92%和85%
经BICR评估的PFS
主要终点经BICR评估的PFS。
中位PFS:39.1月vs 5.6月 HR 0.16(95%CI 0.10, 0.24),P<0.001。(2017年报告的PACIFIC研究结果,对照组接受标准同步放化疗的III期 NSCLC的中位PFS也为5.6月)
1年PFS率 74% vs 22%;2年PFS率 65% vs 13%。
研究者评估的PFS作为敏感性分析,中位PFS 38.9月 vs 7.3月 HR 0.19(95%CI 0.12, 0.29)与BICR评估结果总体接近。
在所有主要亚组中,奥希替尼巩固治疗都显示出获益。
两组事件数少于20例的亚组排除在亚组分析以外,HR作为无法计算(Not Calculable,NC)。
BICR评估PFS的亚组分析,两组事件数少于20例为无法计算NC
肿瘤缓解和新发转移部位
肿瘤缓解方面,ORR 57% vs 33%,DCR 89% vs 79% 中位缓解时间 36.9月vs 6.5月。
BICR评估的肿瘤缓解
BICR评估新发转移部位
新发转移部位方面,奥希替尼可以减少局部和远处转移。尤其减少了同步放化疗之后脑转移的发生,试验组与对照组新发脑转移的发生率分别为8%和29%。
OS结果
OS目前成熟度仅为20%,有81%对照组进展的患者接受了奥希替尼的交叉治疗,可能减少OS的差异。
尽管如此,还是显示出OS的获益趋势。目前中位OS 为54.0月 vs NR HR 0.81 (95%CI 0.42-1.56)。根据研究检验分析策略,将会在成熟度为60%左右的时候进行OS 终分析。
中期分析的总生存,成熟度20%
安全性
治疗暴露及安全性总结
治疗期间不良事件
安全性方面,两组3级以上不良事件发生率分别为35%和12%。试验组导致停药和减量的比例分别13%和8%。
不良事件,除了放化疗相关的放射性肺炎以外,主要为腹泻和皮疹。与既往奥希替尼研究的表现一致。
肺炎的发生率方面,试验组间质性肺疾病(包括ILD,肺炎、肺纤维化)发生率是8% ,大部分是1-2级,对照组发生率为1%。
同期全文发表
研究结果同步发表于NEJM,中国研究者陆舜教授作为研究的兼通讯作者。
ASCO同期于NEJM发表全文结果
总结
本次ASCO全体大会报告了LAURA研究结果,奥希替尼对比安慰剂用于III期EGFR突变NSCLC放化疗后的巩固治疗。研究达成了主要终点,显著提升了患者的PFS,中位PFS 39.1月vs 5.6月 HR 0.16(0.10, 0.24) 。
OS中期分析在20%成熟度以及81%对照组接受交叉治疗的情况下,显示出获益趋势,将在60%成熟度时进行OS 终分析。
对于III期NSCLC,LAURA无疑是改变标准治疗的里程碑研究。今年正是发现NSCLC中EGFR突变的20周年,靶向EGFR也成为精准治疗的代表之一。奥希替尼在NSCLC的探索给患者带来获益的同时,对其他突变的靶向治疗开发也具有借鉴意义。
(以下内容仅供参考,具体用药详情请谨遵医嘱)
奥希替尼-说明书
适应症
1、EGFR 突变阳性非小细胞肺癌 (NSCLC) 的辅助治疗
奥希替尼(泰瑞沙)适用于通过 FDA 批准的检测方法检测到肿瘤存在表皮生长因子受体 (EGFR) 外显子19缺失或外显子 21 L858R 突变的非小细胞肺癌 (NSCLC) 成人患者肿瘤切除后的辅助治疗。
2、EGFR 突变阳性转移性 NSCLC 的一线治疗
奥希替尼(泰瑞沙)适用于一线治疗肿瘤携带 EGFR 外显子19缺失或外显子 21 L858R 突变(通过 FDA 批准的检测方法检测)的转移性 NSCLC 成人患者。
3、EGFR 突变阳性局部晚期或转移性 NSCLC 的一线治疗
奥希替尼(泰瑞沙)联合培美曲塞和铂类药物化疗适用于肿瘤携带 EGFR 外显子19缺失或外显子 21 L858R 突变(通过 FDA 批准的检测方法检测)的局部晚期或转移性 NSCLC 成人患者的一线治疗。
4、既往接受过治疗的 EGFR T790M 突变阳性转移性 NSCLC
奥希替尼(泰瑞沙)适用于治疗 EGFR 酪氨酸激酶抑制剂 (TKI) 治疗期间或治疗后疾病进展的转移性 EGFR T790M 突变阳性 NSCLC 成人患者(通过 FDA 批准的试验检测)。
图片
适应靶点
EGFR
剂型和规格
奥希替尼(泰瑞沙)薄膜衣片的规格为:
80毫克:米黄色、椭圆形、双凸片剂,一面凹刻“AZ 80”,另一面空白。
40毫克:米黄色、圆形、双凸片剂,一面凹刻“AZ 40”,另一面空白。
用法用量(具体用药详情请谨遵医嘱)
1、开始奥希替尼(泰瑞沙)治疗前的建议评价和检测
1)奥希替尼(泰瑞沙)单药治疗
a.有心脏风险因素的患者在开始奥希替尼(泰瑞沙)单药治疗前进行心脏监测,包括评估左心室射血分数 (LVEF)。
b.在开始奥希替尼(泰瑞沙)治疗前,进行全血细胞计数及分类计数。
2)联合培美曲塞和含铂化疗
a.在开始奥希替尼(泰瑞沙)联合培美曲塞和铂类药物化疗前,对所有患者进行心脏监测,包括评估左心室射血分数 (LVEF)。
b.在开始奥希替尼(泰瑞沙)治疗前,进行全血细胞计数及分类计数 。
2、患者选择
1)EGFR 突变阳性 NSCLC 的辅助治疗
基于肿瘤标本中存在 EGFR 外显子19缺失或外显子 21 L858R 突变,选择可切除肿瘤患者作为 奥希替尼(泰瑞沙)NSCLC 的辅助治疗。
2)EGFR 突变阳性转移性 NSCLC 的一线治疗
基于肿瘤或血浆标本中存在 EGFR 外显子19缺失或外显子 21 L858R 突变,选择局部晚期或转移性 EGFR 阳性 NSCLC 伴奥希替尼(泰瑞沙)患者作为一线治疗 。如果在血浆标本中未检测到这些突变,则在可行的情况下检测肿瘤组织。
3)EGFR 突变阳性局部晚期或转移性 NSCLC 的一线治疗
基于肿瘤或血浆标本中存在 EGFR 外显子19缺失或外显子 21 L858R 突变,选择奥希替尼(泰瑞沙)联合培美曲塞和铂类药物化疗一线治疗局部晚期或转移性 EGFR 阳性 NSCLC 的患者。如果在血浆标本中未检测到这些突变,则在可行的情况下检测肿瘤组织。
4)既往接受过治疗的 EGFR T790M 突变阳性转移性 NSCLC
基于肿瘤或血浆标本中存在 EGFR T790M 突变,选择 EGFR TKI 治疗期间或治疗后疾病进展的转移性 EGFR T790M 突变阳性 NSCLC 奥希替尼(泰瑞沙) 患者。仅建议无法获得肿瘤活检的患者检测血浆标本中是否存在 T790M 突变。如果在血浆标本中未检测到该突变,重新评价活检进行肿瘤组织检测的可行性。
3、推荐用法用量
1)推荐用法用量
下表按适应症提供了奥希替尼(泰瑞沙)的推荐剂量。
表:奥希替尼(泰瑞沙)的推荐剂量
2)给药
奥希替尼(泰瑞沙)80毫克片剂口服给药,每日一次,与或不与食物同服。对于吞咽困难或鼻胃管给药的患者,可将片剂分散在水中。
3)遗漏剂量
如果漏服一剂奥希替尼(泰瑞沙),请勿补服漏服的剂量,并按计划服用下一剂。
4、难以吞咽固体的患者给药
仅将片剂分散于60毫升(2盎司)非碳酸水中。搅拌,直至片剂分散成小块(片剂不会完全溶解),立即吞服。制备过程中请勿压碎、加热或超声处理。用 120毫升至240毫升(4至8盎司)水冲洗容器,并立即饮用。
如果需要通过鼻胃管给药,将片剂按上述方法分散在15毫升非碳酸水中,然后再用15毫升水将任何残留物转移至注射器中。结果应按照鼻胃管说明给予 30毫升液体,并使用适当的水冲洗(约30毫升)。重复该步骤,直至注射器中无碎片残留。这将有助于确保给予奥希替尼(泰瑞沙)的完整处方剂量。分散和残留应在片剂加入水中后30分钟内给药。
5、针对不良反应的剂量调整
不良反应的推荐减量见下表。
表:奥希替尼(泰瑞沙)的推荐剂量调整
*根据美国国家癌症研究所不良事件通用术语标准第5.0版 (NCI CTCAE v5.0) 分级的不良反应。
†QTc = 按心率校正的 QT 间期
‡ECG = 心电图
1)联合治疗的剂量调整
当奥希替尼(泰瑞沙)与培美曲塞和含铂化疗联合给药时,酌情调整任何一种治疗的剂量,以管理不良反应。奥希替尼(泰瑞沙)剂量调整说明见表。根据各自的处方信息暂停、减量或 久停用培美曲塞、顺铂或卡铂。
2)药物相互作用
强效 CYP3A4 诱导剂
避免强效 CYP3A4 诱导剂与奥希替尼(泰瑞沙)合并使用。如果无法避免同时使用,当与强效CYP3A 诱导剂联合给药时,将奥希替尼(泰瑞沙)剂量增加至每日160毫克。
停用强效 CYP3A4 诱导剂后3周,以80毫克重新开始奥希替尼(泰瑞沙)治疗。
不良反应
1、严重副作用:
1)间质性肺病/非感染性肺炎
2)QTc 间期延长
3)心肌病
4)角膜炎
5)多形性红斑、Stevens-Johnson综合征和中毒性表皮坏死松解症
6)皮肤血管炎
7)再生障碍性贫血
2、常见副作用
1)白细胞计数低、血小板计数低、红细胞计数低(贫血)
2)肌肉、骨骼或关节痛
3)皮肤干燥、口腔溃疡、疲倦、腹泻、皮疹
4)指(趾)甲变化,包括:发红、压痛、疼痛、炎症,脆性、与甲床分离,甲脱落等。
3、奥希替尼(泰瑞沙)联合培美曲塞和含铂化疗的 常见副作用包括:
1)白细胞计数低、血小板计数低
2)皮肤干燥、皮疹、腹泻、口腔溃疡
3)指(趾)甲变化,包括:发红、压痛、疼痛、炎症,脆性、与甲床分离,甲脱落等。
禁忌症
1. 对甲磺酸奥希替尼过敏者禁用。
2. 妊娠期妇女禁用。
3. 哺乳期妇女应权衡对其的重要性,选择停药或停止哺乳。
4. 儿童用药的安全性及有效性尚未确定,慎用。
5. 重度肾功能不全及终末期肾病患者的安全性尚未明确,慎用。
6. 中、重度肝功能不全的患者安全性尚未明确,也应慎用。
7. 一线用药前必须明确有经国家药品监督管理局批准的EGFR基因检测方法检测到的EGFR19外显子缺失突变或21外显子L858R置换突变阳性的患者。
8. 对于既往经EGFR-TKI治疗时或治疗后出现疾病进展的患者,用药前必须明确有经国家药品监督管理局批准的检测方法检测到EGFR-T790M突变。
在使用甲磺酸奥希替尼片时,还需注意与某些药物的相互作用,如禁止与圣约翰草一起服用,CYP3A4的中度诱导剂(如波生坦、依法韦仑、依曲韦林和莫达非尼)也可降低本品的暴露量,因此应该慎用,如有可能也应避免使用。建议应避免同时使用本品和CYP3A4的强诱导剂(如苯妥英、利福平和卡马西平)。当奥希替尼与CYP3A的强诱导剂合并用药难以避免时,需要增加奥希替尼的剂量至每日160mg。停止服用CYP3A4的强诱导剂后3周,奥希替尼的剂量可恢复至每日80mg。
注意事项
1、间质性肺病/非感染性肺炎
1813例奥希替尼(泰瑞沙)治疗患者中有4%发生间质性肺病 (ILD)/非感染性肺炎;0.4%的病例为致死性。
在 FLAURA2 研究中,276例接受奥希替尼(泰瑞沙)联合培美曲塞和铂类药物化疗的患者中,3.3%发生 ILD/肺炎;0.4%的病例为致死性。
暂停奥希替尼(泰瑞沙),并在出现可能提示 ILD 的呼吸道症状恶化(例如呼吸困难、咳嗽和发热)的患者中及时研究ILD。如果确诊 ILD/非感染性肺炎,则 久停用奥希替尼(泰瑞沙)。
2、QTc 间期延长
接受奥希替尼(泰瑞沙)治疗的患者发生心率校正的 QT(QTc) 间期延长。在临床试验中接受奥希替尼(泰瑞沙)单药治疗的1813例患者中,发现1.1%的患者具有 QTc> 500毫秒,4.3%的患者 QTc 较基线延长 > 60毫秒。
在 FLAURA2 研究中接受 奥希替尼(泰瑞沙)联合培美曲塞和铂类药物化疗的276例患者中,发现1.8%的患者QTc > 500毫秒,10.5%的患者 QTc 较基线延长 > 60毫秒。
未报告 QTc 相关心律失常。
奥希替尼(泰瑞沙)的临床试验未入组基线QTc > 470毫秒的患者。对于先天性长 QTc 综合征、充血性心力衰竭、电解质异常或正在使用已知可延长 QTc 间期药物的患者,应定期进行 ECG 和电解质监测。发生 QTc 间期延长伴危及生命的心律失常体征/症状的患者 久停用奥希替尼(泰瑞沙)。
3、心肌病
在临床试验中,1813例奥希替尼(泰瑞沙)治疗患者中有3.8%发生心肌病(定义为心力衰竭、慢性心力衰竭、充血性心力衰竭、肺水肿或射血分数降低);0.1%的心肌病病例为致死性。
在 FLAURA2 研究中,276例接受中午联合培美曲塞和铂类药物化疗的患者中,9%发生心肌病;1.1%的心肌病病例为致死性。
在1557例接受了基线和至少1次随访 LVEF 评估的患者中,4.2%的患者左心室射血分数 (LVEF) 相对于基线降低≥10个百分点,LVEF降至50%以下。在 ADAURA 研究中,1.5%(5/325) 接受 TAGRISSO 治疗的患者出现 LVEF 降低大于或等于10个百分点,降至50%以下。在 FLAURA2 研究中,8%(21/262) 接受奥希替尼(泰瑞沙)联合培美曲塞和铂类药物化疗的患者(具有基线和至少一次随访 LVEF 评估)发生 LVEF 降低≥10个百分点,并降至50%以下。
对于将接受奥希替尼(泰瑞沙)单药治疗的患者,在有心脏风险因素的患者中进行心脏监测,包括评估基线和治疗期间的LVEF。
对于将接受奥希替尼(泰瑞沙)联合培美曲塞和铂类药物化疗的患者,在所有患者中进行心脏监测,包括基线和治疗期间评估LVEF。
评估治疗期间出现相关心脏体征或症状的患者的LVEF。对于症状性充血性心力衰竭, 久停用奥希替尼(泰瑞沙)。
4、角膜炎
在临床试验中,接受奥希替尼(泰瑞沙)单药治疗的1813例患者中有0.6%报告了角膜炎。出现提示角膜炎的体征和症状(如眼部炎症、流泪、光敏感、视力模糊、眼痛和/或红眼)的患者应及时转诊至眼科医生。
5、重症多形性红斑、Stevens-Johnson综合征和中毒性表皮坏死松解症
在接受奥希替尼(泰瑞沙)的患者中报告了符合重型多形性红斑 (EMM)、Stevens-Johnson综合征 (SJS) 和中毒性表皮坏死松解症 (TEN) 的上市后病例。如果怀疑EMM、SJS或TEN,则停用奥希替尼(泰瑞沙),如果证实,则 久停药。
6、皮肤血管炎
在接受奥希替尼(泰瑞沙)的患者中报告了皮肤血管炎的上市后病例,包括白细胞破碎性血管炎、荨麻疹性血管炎和 IgA 血管炎。如果怀疑皮肤血管炎,暂停奥希替尼(泰瑞沙)治疗,评价全身受累情况,并考虑皮肤科会诊。如果无法确定其他病因,根据严重程度考虑 久停用奥希替尼(泰瑞沙)。
7、再生障碍性贫血
在临床试验(1813例中的0.06%)和上市后接受奥希替尼(泰瑞沙)治疗的患者中报告了再生障碍性贫血。一些病例有致死性结局。告知患者再生障碍性贫血的体征和症状,包括但不限于新发或持续发热、瘀伤、出血和苍白。如果怀疑再生障碍性贫血,暂停奥希替尼(泰瑞沙)并进行血液学会诊。如果确诊为再生障碍性贫血,则 久停用奥希替尼(泰瑞沙)。
在开始奥希替尼(泰瑞沙)治疗前进行全血细胞计数和分类计数,在整个治疗期间定期进行,如有指征,可更频繁地进行。
8、胚胎-胎儿毒性
基于动物研究的数据及其作用机制,当对孕妇给药时,奥希替尼(泰瑞沙)可导致胎儿损害。在动物生殖研究中,当在早期发育期间以1.5倍于推荐临床剂量暴露量的剂量暴露给药时,奥希替尼(泰瑞沙)导致着床后胎仔丢失。当雄性动物在与未给药雌性动物交配前给药时,当血浆暴露量约为推荐剂量80毫克每日一次观察到的0.5倍时,着床前胚胎丢失增加。在开始奥希替尼(泰瑞沙)治疗前,验证有生育能力女性的妊娠状态。告知孕妇对胎儿的潜在风险。建议有生育能力的女性在奥希替尼(泰瑞沙)治疗期间和末次给药后6周内采取有效的避孕措施。建议女性伴侣有生育能力的男性在末次给药后4个月内采取有效的避孕措施。
特殊人群用药
1、妊娠期
基于动物研究的数据及其作用机制,当对妊娠女性给药时,奥希替尼(泰瑞沙)可导致胎儿损害。尚无妊娠女性使用奥希替尼(泰瑞沙)的可用数据。当血浆暴露量为推荐临床剂量下暴露量的1.5倍时,给予妊娠动物奥希替尼与胚胎致死性和胎仔生长减缓相关。告知孕妇对胎儿的潜在风险。
2、哺乳期
尚无关于人乳汁中存在奥希替尼(泰瑞沙)或其活性代谢物、奥希替尼(泰瑞沙)对母乳喂养婴儿或乳汁生成影响的数据。在妊娠和哺乳早期对动物给药与不良反应相关,包括生长速率降低和新生儿死亡。由于奥希替尼(泰瑞沙)可能导致母乳喂养婴儿发生严重不良反应,建议女性在奥希替尼(泰瑞沙)治疗期间和末次给药后2周内不要哺乳。
3、具有生殖潜力的男性和女性
根据动物数据,奥希替尼(泰瑞沙)在导致暴露量为每日80毫克临床剂量下人体暴露量的1.5倍或以下的剂量下可导致畸形、胚胎死亡和出生后死亡。
在开始奥希替尼(泰瑞沙)治疗前,验证有生育能力女性的妊娠状态。
建议有生育能力的女性在奥希替尼(泰瑞沙)治疗期间和末次给药后6周内采取有效的避孕措施。
建议有生育能力女性伴侣的男性患者在奥希替尼(泰瑞沙)给药期间和末次给药后4个月内采取有效的避孕措施。
基于动物研究,奥希替尼(泰瑞沙)可能损害有生育能力的女性和男性的生育力。对女性生育力的影响呈可逆性趋势。尚不清楚对男性生育力的影响是否可逆。
4、儿童使用
奥希替尼(泰瑞沙)在儿科患者中的安全性和有效性尚未确定。
5、老年用药
1)单药治疗
在接受奥希替尼(泰瑞沙)单药治疗的1813例 EGFR 外显子19缺失或外显子 21 L858R 突变阳性 NSCLC 患者中,770例患者≥65岁,207例患者≥75岁。探索性分析表明,与65岁以下患者相比,65岁或以上患者中3级或以上不良反应的发生率更高 (43%vs 33%),且因不良反应调整剂量的频率更高 (34%vs 23%)。未观察到65岁或以上患者与年轻患者之间在安全性或有效性方面存在总体差异。
2)奥希替尼(泰瑞沙)联合培美曲塞和含铂化疗
在276例接受奥希替尼(泰瑞沙)联合培美曲塞和铂类化疗的 EGFR 外显子19缺失或外显子 21 L858R 突变阳性的局部晚期或转移性 NSCLC 患者中,104例患者≥65岁,23例患者≥75岁。探索性分析表明,与65岁以下患者相比,65岁或以上患者中3级或以上不良反应的发生率更高 (68%vs 61%),且因不良反应调整剂量的频率更高 (55%vs 43%)。奥希替尼(泰瑞沙)联合培美曲塞和含铂化疗的临床研究未纳入足够数量的65岁及以上患者,无法确定其反应是否与年轻患者不同。
6、肾功能损害
根据 Cockcroft-Gault 估计,肌酐清除率 (CLcr) 为 15-89毫升/分钟的患者不建议调整剂量。对于终末期肾病 (CLcr < 15毫升/分钟) 患者,无推荐剂量的奥希替尼(泰瑞沙)。
7、肝功能损害
轻度至中度肝损害患者(Child-Pugh A级和 B 级或总胆红素≤ULN且AST > ULN或总胆红素1-3倍 ULN 和任何AST)不建议调整剂量。对于重度肝损害患者(总胆红素在3-10倍 ULN 和任何 AST 之间),奥希替尼(泰瑞沙)无推荐剂量。
药物相互作用
1、其他药物对奥希替尼(泰瑞沙)的影响
强效 CYP3A 诱导剂
与千单独给药相比,千与强效 CYP3A4 诱导剂联合给药降低了奥希替尼的暴露量。奥希替尼暴露量降低可能导致疗效降低。
避免奥希替尼(泰瑞沙)与强效 CYP3A 诱导剂联合给药。如果无法避免同时使用,当与强效 CYP3A4 诱导剂联合给药时,增加奥希替尼(泰瑞沙)剂量。奥希替尼(泰瑞沙)与中效和/或弱效CYP3A诱导剂联合使用时无需调整剂量。
2、奥希替尼(泰瑞沙)对其他药物的影响
与奥希替尼(泰瑞沙)单独给药相比,奥希替尼(泰瑞沙)与乳腺癌耐药蛋白 (BCRP) 或 P-糖蛋白 (P-gp) 底物联合给药增加了底物的暴露量。BCRP或 P-gp 底物暴露量增加可能增加暴露相关毒性的风险。
当与奥希替尼(泰瑞沙)2联合给药时,监测 BCRP 或 P-gp 底物的不良反应,除非其批准的标签中另有说明。
3、延长 QTc 间期的药物
已知与奥希替尼(泰瑞沙)联合给药可延长QTc间期的药物的作用尚不清楚。可行时,避免合并使用已知可延长QTc间期且具有已知尖端扭转型室性心动过速风险的药物。如果无法避免合并使用此类药物,应定期进行ECG监测。
成分
活性成分:osimertinib
非活性成分:甘露醇、微晶纤维素、低取代羟丙纤维素和硬脂富马酸钠。片剂包衣含有:聚乙烯醇、二氧化钛、聚乙二醇3350、滑石、氧化铁黄、氧化铁红和氧化铁黑。不含乳糖、蔗糖、面筋、柠檬黄或任何其他偶氮染料。
贮存方法
1、奥希替尼(泰瑞沙)在20°C-25°C室温下储存。
2、安全丢弃过期或您不再需要的药物。
3、将奥希替尼(泰瑞沙)和所有药品放置在儿童接触不到的地方。
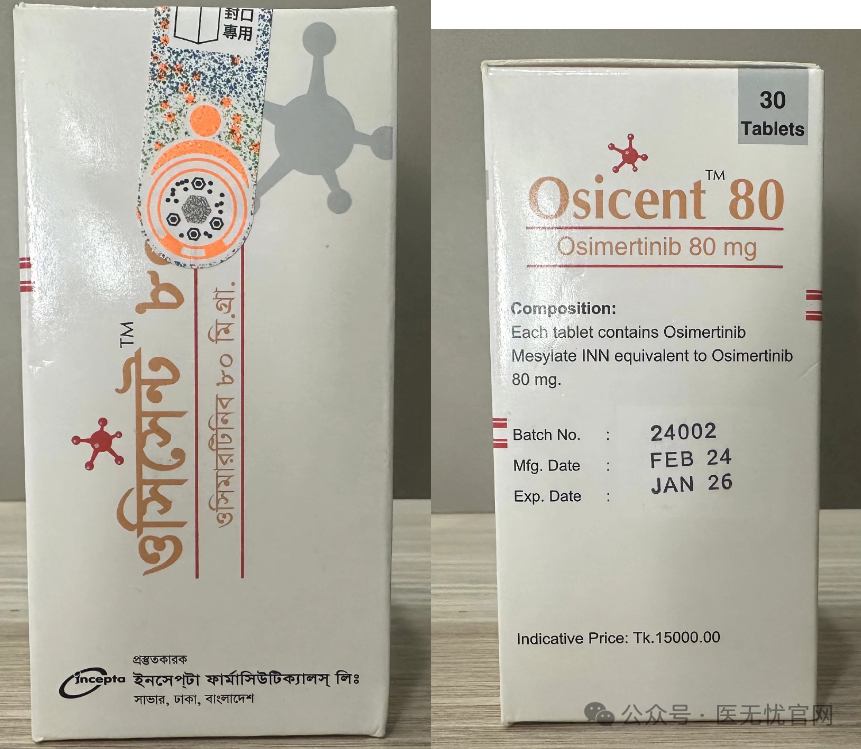
奥希替尼(泰瑞沙)的价格:
原研药价格:
在国内,阿斯利康制药版的奥希替尼价格已经有所下调,目前大约在每盒1.7万元左右,相较于之前的价格有显著下降。然而,这个价格可能会因地区和药房的不同而有所变化。
仿制药价格:
仿制药价格很低,目前厂家来自印度、老挝、孟加拉等等。如有需要请扫描下方二维码添加客服微信获取报价单。
免责申明:本文章中内容仅供一般参考,不可直接作为决策内容,不对任何主体因使用本文内容而导致的任何损失承担责任。


 医无忧服务热线:
医无忧服务热线:
