 400-028-6288
400-028-6288 在线客服
在线客服
 官方微信
官方微信
 400-028-6288
400-028-6288 在线客服
在线客服
 官方微信
官方微信

新闻动态
所谓的免疫检查点受体表达于 T 淋巴细胞的表面膜上,可调节甚至减弱免疫反应的强度,以防止生理状态下的过度刺激。在多种实体肿瘤中,免疫检查点配体上调,与 T 淋巴细胞上的检查点受体结合,使肿瘤细胞通过被免疫系统耐受而逃避抗肿瘤免疫反应。抑制性免疫检查点可以通过药物靶向治疗,包括细胞毒性 T 淋巴细胞相关蛋白 4 (CTLA-4)、程序性细胞死亡蛋白 1 (PD-1)、淋巴细胞活化基因 3 (LAG3)、T 细胞免疫球蛋白和粘蛋白结构域-3 (TIM-3) 以及具有 Ig 和 ITIM 结构域的 T 细胞免疫受体 (TIGIT)。
免疫检查点抑制剂是阻断免疫检查点受体与其配体之间相互作用的单克隆抗体。通过这种方式,它们主要通过激活 T 细胞来增强人体的抗肿瘤免疫反应。PD-1 的配体是程序性细胞死亡配体 1 (PD-L1) 和程序性细胞死亡配体 2 (PD-L2),而 CTLA-4 与分化簇 80/86 (CD80/86) 结合。PD-L1 和 PD-L2 表达发生在各种肿瘤细胞中,包括 HCC,向 T 细胞传递抑制信号并促进肿瘤细胞中的免疫逃逸机制。
在HCC中,CPI主要针对PD-1、PD-L1和细胞毒性CTLA-4。HCC通常会产生免疫抑制微环境,使癌细胞逃避免疫检测和攻击。CPI通过阻断这些检查点蛋白起作用,重新激活免疫系统识别和消灭癌细胞的能力。CPI单一疗法在HCC中的使用之前已在某些患者中显示出良好的效果,可产生持久的反应并提高生存率。然而,并非所有患者对这些疗法的反应都相同,并且有效性可能因肿瘤微环境、免疫细胞浸润水平和特定生物标志物(如PD-L1)的表达等因素而异。CPI与其他治疗剂或治疗方式的联合疗法也在探索中,例如靶向疗法或局部治疗,如经动脉化疗栓塞术(TACE)或射频消融术(RFA)。这些组合旨在增强整体抗癌免疫反应并可能改善 HCC 患者的治疗结果。
CheckMate 040 是一项大型 I/II 期多队列试验 (NCT01658878),旨在评估 nivolumab(PD-1 抑制剂)对既往接受过索拉非尼治疗的晚期 HCC 患者的安全性和有效性。该试验包括一项 1 期剂量探索方案(队列 1),共纳入 48 名患者(n=9 名未接受过索拉非尼治疗,n=37 名接受过索拉非尼治疗), 终选择 3 mg/kg 剂量用于后续剂量扩展阶段。在 Ib 期剂量扩展方案(队列 2)中,共有 214 名患者(69 名索拉非尼初治患者, 145名索拉非尼预治患者)接受了 nivolumab 单药治疗,分为 4 个组(未接受索拉非尼治疗或对索拉非尼不耐受且无病毒性肝炎、索拉非尼进展且无病毒性肝炎、HCV 感染和 HBV 感染)。剂量扩展部分的 ORR 为 20%(95% CI,15–26),剂量递增部分的 ORR 为 15%(95% CI,6–28)。对于在剂量递增阶段接受过索拉非尼治疗的患者,mOS 为 15 个月(95% CI,9.6–20.2)。在 终报告中,对于在索拉非尼治疗期间病情进展或对索拉非尼不耐受的晚期 HCC 患者,在剂量递增或剂量扩展阶段接受了 3 mg/kg 纳武单抗治疗(n=154),ORR 为 14.3%(95% CI,9.2-14.3),中位 OS 为 15.15 个月(95% CI,13.24-18.14),中位 PFS 为 2.83 个月(95% CI,2.66-4.04)。基于这些结果,2017 年,FDA 加速批准纳武单抗用于治疗既往接受过索拉非尼治疗的 HCC 患者。2021 年,由于 CheckMate 459 试验的阴性结果,纳武单抗的批准被撤销,该试验研究了纳武单抗在一线治疗中的疗效。这项 III 期试验 (NCT02576509) 比较了纳武单抗与索拉非尼在一线治疗中的疗效,共招募了 1009 名患者,并随机分配接受纳武单抗(每 2 周静脉注射 240 mg)或索拉非尼(每天两次口服 400 mg)。尽管招募了 1009 名患者,但该试验在主要终点总生存期方面未达到统计学意义。纳武单抗组的 mOS 为 16.4 个月(95% CI,13.9-18.4),索拉非尼组的 mOS 为 14.7 个月(95% CI,11.9-17.2)(风险比 0.85(95% CI,0.72-1.02);p=0.075)。
I/II 期 CheckMate 040 队列 4 研究了纳武单抗联合伊匹单抗治疗晚期 HCC 患者的二线疗效。研究了三个给药组的安全性和有效性。其中,A 组(包括伊匹单抗 3 mg/kg 加纳武单抗 1 mg/kg,每 3 周一次,共给药 4 次,之后每 2 周进行一次纳武单抗单药治疗(240 mg))的结果 有希望。A 组报告的 ORR 为 32%,无论基线病因或 PD-L1 状态如何,mOS 为 22.8 个月(95% CI,9.4 - 未达到)。因此,2021 年,FDA 在美国加速批准纳武单抗联合伊匹单抗用于治疗既往接受过索拉非尼治疗的 HCC 患者。CheckMate 040 的第 5 队列评估了 nivolumab 联合 ipilimumab 在 Child–Pugh B 级肝硬化患者中的应用,结果显示该疗法安全性良好,毒性可控。
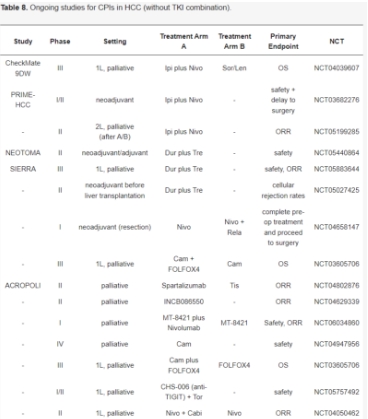
正在进行的 CheckMate 9DW (NCT04039607) III 期试验目前正在评估伊匹单抗加纳武单抗联合治疗与索拉非尼或仑伐替尼在姑息治疗中的一线治疗效果。一份新闻稿宣布,CheckMate 9DW 试验已达到其作为晚期 HCC 一线治疗的主要终点,即总生存期。
KEYNOTE-224 试验(II 期,NCT02702414)评估了帕博利珠单抗(一种针对 PD-1 受体的单克隆抗体)对既往接受过索拉非尼治疗的晚期 HCC 患者的效果。该研究招募了 104 名接受帕博利珠单抗(200 mg)治疗的患者,每 3 周一次。帕博利珠单抗显示出良好的临床疗效,报告的 ORR 为 17%(95% CI,11-26),mOS 为 12.9个月(95% CI,9.7-15.5),mPFS 为 4.9个月(95% CI,3.4-7.2)[ 135 ]。2022 年公布了更新的疗效结果,反映了 2.5 年的延长随访,结果显示 ORR 为 18.3%(95% CI,11.4-27.1),mPFS 为 4.9个月(95% CI;3.5-6.7),mOS 为 13.2个月(95% CI,9.7-15.3)。因此,基于这些结果,FDA 于 2018 年加速批准 pembrolizumab 用于治疗先前接受过索拉非尼治疗的晚期 HCC 患者。
随后的随机 KEYNOTE-240 试验(III 期,NCT02702401)比较了帕博利珠单抗与安慰剂在晚期 HCC 患者二线治疗中的疗效。虽然报告的结果与 KEYNOTE-224 试验的结果相似,但 OS 和 PFS 未达到指定标准的统计学意义。 近发表的一项长期分析,随访期约为 40个月,显示帕博利珠单抗的 mOS 为 13.9个月(95% CI,11.6-16.0),而安慰剂的 mOS 为 10.6个月(95% CI,8.3-13.5)。帕博利珠单抗组的 mPFS 为 3.3个月(95% CI,2.8-4.1),安慰剂组为 2.8个月(95% CI,1.6-3.0),帕博利珠单抗组的 ORR 为 18.3%,安慰剂组为 4.4%。尽管未达到预先设定的统计学意义,但帕博利珠单抗继续表现出良好的抗肿瘤活性,尤其是在 初对治疗有反应的患者中。KEYNOTE-394 试验(III 期,NCT03062358)在既往接受过治疗的晚期 HCC 亚洲人群中研究了帕博利珠单抗与 佳支持治疗的疗效。共入组 453 例患者,主要终点是总生存期。该研究达到了其主要终点,显示派姆单抗组的中位 OS 为 14.6个月(95% CI,12.6-18.0),而 佳支持治疗组为 13.0个月(95% CI,10.5-15.1)。派姆单抗还显著改善了次要终点,中位 PFS 为 2.6个月(95% CI,1.5-2.8),ORR 为 12.7%(95% CI,9.1-17.0)。相比之下, 佳支持治疗组的中位 PFS 为 2.3个月(95% CI,1.4-2.8),ORR 为 1.3%(95% CI,0.2-4.6)。
RATIONALE-208 试验(II 期,NCT03419897)在既往接受过治疗的晚期 HCC 患者中研究了 PD-1 抑制剂替雷利珠单抗。共入组 249 名患者,每 3 周接受一次替雷利珠单抗单药治疗(200 mg,静脉注射)。观察到的 ORR 为 13%(95% CI,9-18),且该反应与既往治疗数量无关。此外,mOS 为 13.2个月(95% CI,10.8-15.2)。鉴于 RATIONALE-208 的良好结果,随后启动了一项随机 III 期试验 RATIONALE-301(NCT03412773),以确认替雷利珠单抗在晚期 HCC 一线治疗中的疗效。在该试验中,674 名患者随机接受替雷利珠单抗或索拉非尼治疗。主要研究终点旨在确定替雷利珠单抗在中位总生存期方面是否不劣于索拉非尼。该研究成功达到了其主要终点,显示替雷利珠单抗组的中位 OS 为 15.9个月,而索拉非尼组为 14.1个月。值得注意的是,替雷利珠单抗组患者的 ORR 为 14.3%,对照组为 5.4%,替雷利珠单抗组的中位 PFS 为 2.2个月,索拉非尼组为 3.6个月。尽管在 III 期试验中观察到令人鼓舞的结果,但替雷利珠单抗目前尚未获得 FDA 或 EMA 批准。
另一种 PD-1 抑制剂卡瑞利珠单抗正在接受 II 期研究 (NCT02989922) 的评估,该研究涉及之前至少接受过一种全身治疗失败的晚期 HCC 患者。在这项研究中,217 名患者被随机分配接受卡瑞利珠单抗治疗,剂量为每 2 或 3 周 3 mg/kg(静脉注射)。ORR 为 14.7%(95% CI,10.3–20.2),mOS 为 13.8个月(95% CI,11.5–16.6)。该研究提供了抗肿瘤疗效的证据。目前,尚无卡瑞利珠单抗单药治疗的 III 期研究。但是, 近对其与阿帕替尼联合治疗的研究将在下文进一步讨论。
继 CheckMate 040 中关于联合使用 nivolumab 和 ipilimumab 疗效的令人鼓舞的数据之后,HCC 治疗中的双重免疫检查点阻断方法目前正在临床试验中进行研究。HIMALAYA 试验对 durvalumab(PD-L1 抑制剂)和 tremelimumab(CTLA-4 抑制剂)的组合进行了研究。这项 III 期试验 (NCT03298451) 招募了 1171 名患者,他们被随机分配到三组:接受 durvalumab(每4周静脉注射1500mg)以及单剂量 tremelimumab(静脉注射300mg)的患者、durvalumab 单药治疗或索拉非尼单药治疗的患者。Durvalumab 和 tremelimumab 联合治疗组的 mOS 为 16.43个月(95% CI, 14.16–19.58),单独使用 durvalumab 治疗的患者为 16.56个月(95% CI, 14.06–19.12),索拉非尼治疗组为 13.77个月(95% CI, 12.25–16.13)。durvalumab 和 tremelimumab 联合治疗优于索拉非尼治疗。此外,durvalumab 单药治疗与索拉非尼治疗相比不劣于索拉非尼治疗。根据 HIMALAYA 试验的数据,FDA 和 EMA 批准 durvalumab 加 tremelimumab 联合治疗用于治疗初治患者的晚期 HCC。
然而,目前尚未批准将 durvalumab 用于单药治疗。在一项 II 期临床试验 (NCT01008358) 中,tremelimumab 单药治疗对 HCV 诱发的肝硬化晚期 HCC 患者表现出良好的抗肿瘤疗效。一项 I/II 期试验 (NCT02519348) 进一步研究了 durvalumab 和 tremelimumab 单药治疗与 durvalumab 和 tremelimumab 联合治疗的比较。该试验还研究了 tremelimumab 和 durvalumab 的推荐剂量,即 STRIDE 方案,并显示出 令人鼓舞的疗效和安全性。STRIDE 方案显示 ORR 为 24.0%(95% CI,14.9–35.3),mOS 为 18.7个月(95% CI,10.8–27.3)。Durvalumab 单药治疗的 ORR 为 10.6%(95% CI, 5.4–18.1),mOS 为 13.6个月(95% CI, 8.7–17.6),而 tremelimumab 单药治疗的 ORR 为 7.2%(95% CI, 2.4–16.1),mOS 为 15.1个月(95% CI, 11.3–20.5)。
近,通过各种临床试验,人们已经对针对免疫检查点 LAG3 和 TIGIT 进行了大量探索。长时间暴露于抗原会刺激 T 细胞功能失调和衰竭,随后导致 PD-1、LAG3 和 TIGIT 等免疫检查点的上调。在癌症的情况下,与这些免疫检查点相关的配体由肿瘤细胞和肿瘤微环境中的抗原呈递细胞 (APC) 表达。在正常情况下,LAG3 在幼稚 T 细胞中不存在。然而,在刺激 CD4+ 和 CD8+ T 细胞后,LAG3 会发生上调。这种上调有助于缓和免疫反应的强度并防止自身免疫过程。LAG3 是 T 细胞增殖、活化和稳态的负调节剂。其主要配体之一纤维蛋白原样蛋白 1 (FGL1) 在实体肿瘤细胞表面显著上调。在癌症患者中,TIGIT 也由活化的 T 细胞、自然杀伤细胞和调节性 T 细胞上调。CD155 和 CD112 是 TIGIT 的重要配体,在肿瘤微环境中的肿瘤细胞和抗原呈递细胞中均有表达。
Relatlimab 是一种 LAG3 抑制剂,目前正在 RELATIVITY-073 试验(II 期,NCT04567615)中研究其与 nivolumab 的联合用药。该试验招募了未接受过免疫治疗但在接受 TKI 治疗时出现肿瘤进展的晚期 HCC 患者。这项试验备受期待的结果尚未公布。此外,RELATIVITY-106 试验(III 期,NCT05337137)中正在研究 relatlimab 与 nivolumab 和贝伐单抗的联合用药。
一项 I/II 期研究 (NCT02460224) 评估了 LAG-3 抑制剂 ieramilimab 对晚期实体瘤患者(其中包括 7 名 HCC 患者)的效果,令人欣喜的是,7 名 HCC 患者中有 2 名表现出 佳反应,病情稳定。
近发表的 MORPHEUS-Liver 研究(Ib/II 期,NCT04524871)探索了 TIGIT 抑制剂替拉戈单抗联合治疗晚期 HCC 患者。该研究招募了 58 名患者,以 2:1 的比例随机分配接受替拉戈单抗(每 3 周静脉注射 300 mg)联合阿替利珠单抗和贝伐单抗治疗或单独接受阿替利珠单抗和贝伐单抗的标准治疗。试验显示 ORR 显著增加。替拉戈单抗组的 ORR 达到了惊人的 42.5%,而对照组为 11.1%。两组的 mPFS 明显不同,替拉戈单抗三联疗法为 11.1个月,而对照组为 4.2个月。有趣的是,基于 PD-L1 状态的亚组之间 ORR 和 PFS 没有显著差异。此外,值得注意的是对照组的表现不佳,阿替利珠单抗和贝伐珠单抗治疗下的 ORR 为 11.5%,明显低于 IMbrave-150 研究的预期数据(ORR 27.3%)。另一项 II 期试验 (AdvanTig206, NCT04948697) 研究了替雷利珠单抗加 BAT1706(贝伐珠单抗生物仿制药)和奥西帕林(抗 TIGIT mAb)的三联疗法与替雷利珠单抗加 BAT1706 的疗效对比。ESMO 2023 上公布的初步数据显示,三联疗法的 ORR 为 35.5%,双联疗法的 ORR 为 37.5%,但未显示出统计学上的显著差异。同样,两组的 mPFS 也没有显著差异(8.3个月 vs 6.9个月)。此外,亚组分析表明,PD-L1 状态大于 1 的肿瘤在 ORR 方面具有潜在优势。


 医无忧服务热线:
医无忧服务热线:
