 400-028-6288
400-028-6288 在线客服
在线客服
 官方微信
官方微信
 400-028-6288
400-028-6288 在线客服
在线客服
 官方微信
官方微信

新闻动态
儿童高级别胶质瘤是一类毁灭性的脑肿瘤,以其侵袭性病理生理学和有限的治疗方法为特征。其中,H3 K27 改变的脑干弥漫性中线胶质瘤 (DMG) 因其独特的分子特征和不良预后而引人注目。分子分析技术的 新进展揭示了 H3 K27 改变,特别是组蛋白 H3 尾部第 27 位赖氨酸到蛋氨酸突变 (K27M) 在 DMG 发病机制中的关键作用。这些突变导致表观遗传失调,从而导致 DMG 肿瘤细胞染色质结构和基因表达模式改变, 终导致 DMG 的侵袭性表型。近年来,对 DMG 的靶向治疗途径的探索势头强劲。包括表观遗传修饰剂、激酶抑制剂和免疫疗法在内的治疗方法正在积极研究中;这些方法旨在破坏异常信号级联并克服 DMG 中的各种治疗耐药机制。血脑屏障穿透和 DMG 肿瘤异质性等挑战需要创新方法来改善药物输送和个性化治疗策略。本综述旨在全面概述对 DMG 不断发展的理解,重点关注驱动肿瘤发生/肿瘤进展的复杂分子机制以及新兴靶向干预措施的当前前景。
1. 简介
中枢神经系统 (CNS) 肿瘤是诊断 多的实体瘤,也是儿童疾病相关死亡的主要原因。脑干高级别胶质瘤占儿童 CNS 恶性肿瘤的 10–20%,其特征是预后特别差。绝大多数曾被认定为弥漫性内在性脑桥胶质瘤 (DIPG) 的高级别脑干胶质瘤现在在 新的 WHO CNS 肿瘤分类中被归类为 H3 K27 改变的弥漫性中线胶质瘤 (DMG)。这些普遍致命的肿瘤以一系列独特的分子改变为特征,这些改变会影响组蛋白 H3 尾部第 27 位 (K27) 的赖氨酸残基。这些修饰 终导致 DMG 肿瘤发生及其侵袭性临床行为。
尽管大多数其他儿童癌症的生存指标均有所改善,但 DMG 患者的预后仍然不容乐观,据报道,中位总生存期 (OS) 不到 12-15 个月。鉴于 DMG 在脑干中的微妙位置及其浸润性生长模式,这些肿瘤可能适合活检但不适合手术切除。与其他神经胶质瘤不同,化疗治疗方法尚未改善 DMG 患者的预后。放射疗法是目前 DMG 治疗的主要手段,尽管它被认为是姑息疗法并且与一些发病率有关。DMG 通常根据其独特的临床病程、神经系统症状和放射学外观进行诊断。然而,对分子生物学理解的迫切需求和新疗法的开发/测试导致细针活检在临床实践中的使用增加。获取 DMG 肿瘤材料不仅可以改善患者分层和组织病理学诊断,还可以提供可用于研究 DMG 生物学的患者组织标本。对 DMG 患者组织(活检和尸检标本)进行测序对于发现现在特征性的 H3 赖氨酸 27 到蛋氨酸 (K27M) 突变和定义生物学上不同的 DMG 亚组等里程碑至关重要。本综述总结了被认为是驱动 DMG 肿瘤发生的分子改变以及 近开发的靶向 DMG 疗法的现状。
2. H3K27修饰DMG的致癌机制
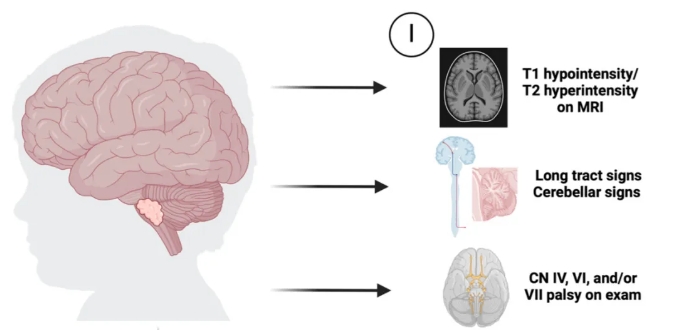
仅使用影像学和临床标准即可诊断 DMG(即磁共振成像 (MRI) 上的 T1 低信号/T2 高信号,伴有临床检查中的长束征、小脑征和/或 CN IV、VI 和 VII 麻痹)。然而,DMG 还表现出独特的组织病理学特征,包括星形细胞形态和具有“粗染色质”模式的细长细胞核。H3K27M DMG 肿瘤可能表现出高级别恶性特征,但由于其侵袭性临床行为,无论确切的组织学特征如何,都被指定为 WHO IV (图1)。
随着 DMG 肿瘤材料的获取渠道日益广泛,更先进的组织病理学诊断工具,如 DNA 测序 (DNA-seq) 或免疫组织化学 (IHC),有助于做出更精准的诊断。2021 年 WHO 中枢神经系统肿瘤分类将以下基因/分子改变定义为 DMG 中的“特征性改变”:H3 K27、TP53、ACVR1、PDGFRA、EGFR 和 EZHIP。2012 年发表的里程碑式研究发现组蛋白 H3 突变是 DMG 肿瘤发生的分子驱动因素。这些发现代表了我们对这种毁灭性肿瘤病理生理基础理解的重大突破。吴等人发现 H3 K27M 突变会导致 H3 K27 三甲基化 (H3 K27me3) 的缺失,尽管这种现象背后的确切机制仍不太清楚。对儿童原发性 GBM 样本的全外显子组测序发现组蛋白 3 变体 H3.3 (H3F3A) 存在反复突变,随后 K27 处的氨基酸被蛋氨酸 (K27M) 取代,G34 处被精氨酸 (G34R) 取代,或被缬氨酸 (G34V) 取代。在 DMG 中也发现了 HIST1H3B(编码 H3.1)发生的突变。
总之,H3 K27M 突变会诱发整体表观遗传变化, 终导致基因表达程序改变,从而“引发”细胞肿瘤发生。Kfoury-Beaumont 等人在 2022 年进行的一项研究表明,H3 K27M 直接干扰分化并促进人类胚胎干细胞的克隆形成。目前的研究表明,H3 K27M 与 EZH2 的结合和关联会导致 PRC2(H3 K27 甲基化的介质)分离和非功能性募集。结果,组蛋白乙酰化增加,而 H3 K27 甲基化整体受到抑制。30% 的 DMG 中发现血小板衍生的生长因子受体 α (PDGFRA) 和 42% 的 DMG 肿瘤中描述的肿瘤蛋白 53 (TP53) 的其他改变与 DMG 肿瘤发生有关。特定的分子改变可能与 DMG 肿瘤的解剖位置以及生存结果有关。在 近的一项研究中,Roberts 等人证明,与没有 MAPK 改变的 DMG 患者相比,丝裂原活化途径激酶 (MAPK) 改变的富集与 DMG 患者的生存期延长相关。根据这些发现,2021 年 WHO 根据 CNS 标准对肿瘤进行分类将 DMG 分为三种亚型:H3 K27M 突变的 DMG、H3 K27M 野生型且 EZHIP 蛋白过表达的 DMG、EGFR 突变或其他分子变化的 DMG。此外,符合所述 DMG 亚型之一的特征性甲基化谱可作为诊断标准。
在表征 DMG 前体细胞的过程中,研究人员确定了位于腹侧脑桥的神经前体细胞群,这些细胞群可能在时间和空间上与 DMG 的发生有关。有趣的是,这些前体细胞表现出上调的 Hedgehog (Hh) 通路活性。此外,该细胞群中很大一部分是 Olig2+,它通常被认为是少突胶质细胞前体细胞的标志物。
3. H3K27变异型DMG的治疗策略:转化进展与挑战
对于 H3K27M 改变的 DMG 患者,迫切需要新的、更有效的治疗策略来改善患者预后。广泛的化疗策略尚未在 DMG 的临床试验中证明有益。因此,专门针对 DMG 分子病理的靶向疗法可能更有价值。目前正在对 DMG 进行临床前研究的靶向疗法包括针对突变组蛋白修饰剂、表观遗传修饰剂和受体酪氨酸激酶等的小分子抑制剂。免疫检查点抑制剂和嵌合抗原受体 (CAR) T 细胞等免疫治疗策略也在探索中。除了开发新的治疗靶点外,向 DMG 肿瘤输送药物仍然是一项重大挑战。与其他脑肿瘤相比,DMG 中的血脑屏障 (BBB) 保存完好,对药物输送构成了重大障碍;因此,药物通常无法在肿瘤内达到治疗剂量。绕过或破坏 BBB 的各种技术(如对流增强输送 (CED) 和聚焦超声 (FUS))已显示出良好的效果,可能能够克服药物输送中的这一巨大障碍(图2)。
4. 超越化疗—H3K27变异型DMG的靶向治疗
4.1. 通路抑制剂
血管内皮生长因子 (VEGF) 和其他生长因子已被证明在神经胶质瘤的发病机制中发挥作用,这引发了人们对使用生长因子抑制剂作为治疗方法的兴趣。生长因子抑制剂也在 DMG 中进行了研究。然而,对 VEGFR2 和表皮生长因子受体 (EGFR) 抑制剂凡德他尼的临床研究并未显示出有意义的生存获益。接受凡德他尼治疗的 DMG 患者即使接受放射治疗也没有获得生存获益。在 DMG 中评估单克隆 VEGFR 抗体贝伐单抗的努力也未能获得一致的有益结果。作为超选择性动脉内脑灌注 ( SIACI ) 给药的贝伐单抗和西妥昔单抗(一种单克隆 IgG1 EGFR 抗体)的组合耐受性良好。该药物组合的疗效以及通过 SIACI 破坏 BBB 的疗效是一个活跃的研究领域。
达沙替尼是一种血小板衍生的生长因子受体 A (PDGFRA) 抑制剂,其临床前研究显示在临床前 DMG 模型中具有良好的活性;此外,其体外抗肿瘤作用通过与 c-Met 抑制剂卡博替尼联合使用而增强。然而,达沙替尼并未发现生存率或临床益处,达沙替尼和卡博替尼联合使用也没有观察到益处。这些治疗的耐受性也不好。一项研究拓扑异构酶 I 抑制剂伊立替康和 EGFR 抑制剂厄洛替尼与贝伐单抗联合使用的研究发现,这种联合使用对高危 DMG 患者的有益作用微乎其微。
由于某些 DMG 存在细胞周期依赖性蛋白激酶 (CDK) 4 和 6 基因扩增,CDK4/6 抑制剂瑞博西尼已在存在这种改变的 DMG 肿瘤中进行了研究。此外,Zuo 等人合成的新型 CDK4/6 抑制剂 (YF-PRJ8-1011) 在体内和体外均表现出优于哌柏西尼的疗效,能相对较好地穿透血脑屏障,并在 DMG 异种移植模型中与放射治疗有协同作用。一项 1/2 期研究 (NCT02607124) 在 DMG 放疗后使用瑞博西尼,证明了可行性,89% 的患者 1 年 OS。目前正在进行一项 I 期试验,通过肿瘤内微透析 (NCT05413304) 确定 abemaciclib 在 DMG 中的药代动力学。
鉴于 DMG 表观基因组的改变,组蛋白去乙酰化酶复合物抑制剂 (HDACi) 等表观遗传修饰剂已被大型药物筛选确定为 DMG 细胞系生长的强效抑制剂。多项研究证实了 HDACi 帕比司他在小鼠 DMG 模型中的疗效,尽管各研究报告的对生存的有益作用并不一致。 近,帕比司他与蛋白酶体抑制剂马里佐米联合使用可改善小鼠 DMG 模型的生存率。研究帕比司他、HDACi 和伏立诺他潜在用途的临床试验正在进行中。EZH2蛋白的抑制剂也在 DMG 中进行研究。具体而言,EZH2 抑制剂 GSK126 可在体外降低 DMG 细胞增殖,可与他汀类药物联合使用,抑制 DMG 体内模型中的肿瘤生长。然而,有必要谨慎使用这些药物,因为 近证明 EZH2 在 DMG 发病机制中发挥肿瘤抑制作用。 后,Brown 等人进行的扩展表观遗传抑制剂库筛选确定蛋白质精氨酸甲基转移酶 (PRMT) 抑制剂是 DMG 的潜在治疗靶点。PRMT5 抑制剂 LLY-283 可在体外降低 DMG 的侵袭性和活力,但无法提高体内生存率。需要开展进一步的研究,以确定 PRMT 抑制剂是否可以用于组合疗法来增强现有疗法。
4.2. ONC201
多巴胺受体 D2 抑制剂 (DRD2i) 和酪蛋白水解蛋白酶 P (ClpP) 激动剂 ONC201 可诱导肿瘤细胞内的线粒体损伤;这种化合物已被证明会在 DMG 细胞系和体内模型中产生活性氧并诱导细胞凋亡。有趣的是,ONC201 还能诱导 DMG 细胞系成熟和分化。Hall 等人的一份病例报告首次证明了 ONC201 在治疗 DMG 方面的临床潜力,其中一名接受 ONC201 治疗的患者在 18 个月时病情稳定,临床症状也有所改善。这些令人鼓舞的发现和早期临床试验的成功促成了 ONC201 的扩大 II 期试验 (NCT02525692),结果显示中位 OS 为 16 个月。此外,德国来源的 ONC201 (gsONC201) 表现出良好的体外和体内活性。在 28 名 H3K27M DMG 患者中对该化合物进行的临床研究发现,中位 OS 为 18 个月;除 GsONC201 外还接受再次放疗的患者的中位 OS 为 22 个月,而未接受额外放疗的患者的中位 OS 为 12 个月。回顾性分析发现,中位 OS 为 19.9 个月,而接受放疗和同步 TMZ 治疗的对照组为 10.9 个月。 后,两项已完成的 1 期研究(NCT03416530 和 NCT03134131)的结果表明,如果患者在 次放疗后但在复发之前接受 ONC201 治疗,中位总生存期增加至 21.7 个月,而复发后治疗则为 9.3 个月。这表明,ONC201 治疗的时机至关重要。进一步的临床试验正在进行中,包括 ONC201 与帕比司他或 PI3K/mTOR 抑制剂帕沙利西联合治疗的 2 期试验 (NCT05009992)。此外,一项多中心、随机、开放标签的 3 期试验 (NCT05476939) 正在比较 ONC201 与 mTOR 抑制剂依维莫司的效果。
4.3. 免疫疗法
DMG 的免疫治疗方法带来了独特的挑战。DMG 被认为是一种免疫学“冷”肿瘤,即使与 GBM 相比也是如此。同样值得注意的是,大多数 DMG 肿瘤弥漫在关键的中脑和脑干结构中,这增加了因免疫原性治疗而导致发病的可能性。在上调抗肿瘤免疫反应与 大限度地降低肿瘤内炎症和水肿风险之间取得平衡,对于 DMG 免疫治疗的成功至关重要。
Mount 等人的研究发现,H3K27M DMG 细胞上双唾液酸神经节苷脂 GD2 的高表达水平是嵌合抗原受体 (CAR) T 细胞的有效靶点;GD2 导向的 CAR T 细胞在患者来源的 DMG 模型中表现出良好的临床前疗效。2022 年一项针对这些 GD2 导向的 CAR T 细胞的剂量递增 I 期试验表明,虽然一些患者表现出“肿瘤炎症相关神经毒性”,但与历史对照相比,该疗法显示出中等的 OS 获益。该试验仍在进行中 (NCT04196413)。其他研究 CAR T 细胞疗法对 DMG 的影响的研究靶向肿瘤表面抗原 B7 同源物 3 蛋白 (B7-H3);B7-H3 CART 细胞的 II 期研究正在进行中 (NCT04185038) 。研究还表明,DMG 肿瘤高度表达 HER2,HER2 CAR-T 细胞疗法在体外和体内均显示出疗效。这导致一些人建议,应将针对脑肿瘤儿童患者的 CAR-T 细胞临床试验扩大到包括 DMG 肿瘤患者。
通过用 nivolumab 抑制程序性细胞死亡蛋白 1 (PD1) 进行免疫检查点抑制未显示出对 DMG 患者的生存益处。针对白细胞介素 13 受体亚基 α 2 (IL-13 Rα2) 的 GB-13 (IL13.E13K-PE4E) 的对流增强递送 (CED) 在体内显示出有希望的临床前结果。对流增强递送通过连接到泵的导管绕过 BBB,泵产生连续的压力梯度并驱动药物溶液流入肿瘤。 后,基于疫苗的 DMG 方法正在早期研究中;临床前研究结果验证了 H3K27M 可作为靶点,在主要组织相容性复合体 (MHC) 人源化小鼠模型中诱导针对 DMG 细胞的肽疫苗的免疫反应。在 8 名成年 DMG 患者中开展的首次人体同情用 H3K27M 特异性长肽疫苗试验表明,该疫苗对人类患者是安全的,且具有免疫原性。该肽疫苗的多中心 1 期试验目前正在进行中 (NCT04808245) 。
5. 改善H3K27改造DMG中的肿瘤内药物输送
血脑屏障 (BBB) 仍然是 DMG 治疗中的一个关键挑战。血脑屏障由内皮细胞 (EC)、毛细血管基底膜、周细胞和星形胶质细胞终足组成。这些结构以及内皮细胞上的转运蛋白和外排泵共同限制外来化合物和其他外来物质进入大脑。药物和/或代谢物的旁细胞运动受 EC 之间紧密连接的调节,而跨细胞通过受外排泵和转运蛋白的调节。在胶质母细胞瘤等脑肿瘤中,血脑屏障和血脑肿瘤屏障 (BBTB) 的完整性受到显著但不均匀的破坏。然而,研究表明,DMG 中的 BBB/BBTB 保存良好。这种不渗透性导致这些肿瘤在增强 T1 MRI 上呈低信号,可能使早期诊断具有挑战性。此外,这种保留的 BBB 完整性使在 DMG 中实现高剂量的有效化疗极具挑战性。为了以有效的肿瘤内剂量实施靶向治疗,正在 DMG 中测试新的药物输送策略,包括 CED、FUS 和动脉内输送(图3)。
改善 DMG 肿瘤内药物输送的方法。1. 对流增强输送 (CED) 绕过血脑屏障 (BBB),通过微导管和正压梯度输送药物。2. 动脉内给药可将药物直接输送到为肿瘤供血的目标动脉。可以添加渗透剂来破坏血脑屏障。3. IV/IT 药物给药可以克服至少一些首过代谢,并且对于 IT 给药,可以绕过 BBB。4. 聚焦超声 (FUS) 可以非侵入性地暂时破坏血脑屏障;该技术可以与微泡结合使用以提高疗效。
5.1. 靶向药物输送系统
在 DMG 中,全身给药通常无法达到显著的肿瘤内药物浓度。此外,为了增加肿瘤内剂量而给予高全身剂量的化疗药物往往会导致全身毒性,尤其是在儿科患者中。CED 通过直接放置微导管并在肿瘤内为药物溶液产生正压梯度来绕过 BBB,为 DMG 提供了一种直接间质给药机制。这种方法可产生更高的肿瘤内药物浓度并限制治疗的不良全身影响。令人鼓舞的临床前研究发现了 CED 给药药物的有益作用,如HDACi帕比司他、EZH2 抑制剂 EPZ-6438 和几种 PI3K/MEK 抑制剂。2018 年, Souweidane等人发表了一项针对 28 名 DMG 患者的剂量递增研究,发现 CED 是一种合理、安全的治疗方法。正如预期的那样,在本研究中,CED 达到了较高的肿瘤内药物浓度。目前正在进行的试验 (NCT03566199 和 NCT04264143) 正在研究 MTX110(一种通过 CED 给药的纳米颗粒形式的帕比司他)在 DMG 中的疗效。为了通过 CED 成功输送药物,必须有几个变量协同作用。除了药物疗效、输注参数和潜在的脑清除机制外,药物的分布容积也是一个不容忽视的重要变量。
鞘内 (IT) 和脑室内 (IV) 给药是实现 CNS 高药物浓度的完善方法。这些方法至少可以克服一些首过代谢,如果是 IT 给药,还可以克服 BBB。IT 应用甲氨蝶呤 (MTX) 通常用于治疗 CNS 转移性急性淋巴细胞白血病和淋巴瘤。多项试验正在进行中,旨在评估 IV 或 IT 作为儿童脑肿瘤(如室管膜瘤和髓母细胞瘤)的药物输送策略 (NCT04958486)。迄今为止,多项试验已为 IV/IT 应用各种药物的可行性和安全性提供了证据。然而,限制疗效的因素(如实质渗透性差和脑清除率快)会降低 IV/IT 在儿童脑肿瘤治疗中的成功率。人们正在积极探索将静脉/肌肉注射给药与纳米技术相结合以提高其疗效的潜力。
除静脉和静脉内途径外,还可使用神经血管内方法到达供给肿瘤的动脉(即靶动脉)并通过该血管直接输送药物。动脉内 (IA) 给药可实现更有针对性的给药,从而 大限度地减少全身副作用。在 IA 给药中使用甘露醇等渗透剂可增加 IA 药物给药期间的 BBB 通透性。渗透剂可诱导内皮细胞收缩和细胞旁通透性,从而增加向脑实质的输送。一项对 436 名成年脑肿瘤患者的研究发现,使用 IA 或 IA 联合渗透性 BBB 破坏进行化疗是安全的。同样,一项 I 期临床试验发现,在 DMG 中通过 IA 输送贝伐单抗和西妥昔单抗与甘露醇联合以诱导 BBB 开放是安全的。值得注意的是,该试验采用了 SIACI。这种 的方法通过仔细选择靶动脉来增加肿瘤内药物浓度并减轻全身毒性,尤其适用于 DMG 肿瘤的精细解剖位置和复杂的血液供应。缓激肽类似物 RMP-7 也被探索作为增加胶质瘤药物吸收的替代机制。然而,一项 RMP-7 与静脉卡铂联合使用的 2 期研究发现,没有证据表明联合方法的疗效有所提高。
后,FUS 与静脉注射的脂质、蛋白质或聚合物微泡相结合,可以非侵入性地暂时破坏 BBB。具体而言,微泡产生的血管内机械力会诱导紧密连接的暂时性开口,从而增加 BBB 通透性。2021 年,MRI 引导的 FUS 被证明可以安全有效地向成年脑转移患者输送单克隆抗体曲妥珠单抗。FUS 在 DMG 的临床前体内模型中耐受性良好。FUS 还被用于提高这些疾病模型中依托泊苷和阿霉素的肿瘤内药物浓度。使用 FUS 已成功抑制了 DMG PDX 模型中的肿瘤生长率, 近的一项研究使用帕比司他和 FUS 结合微泡 (FUS/MB) 显著提高了 DMG 小鼠模型的生存率。一项正在进行的 1 期临床试验正在研究 FUS/MB BBB 破坏和帕比司他治疗对接受放射治疗的 DMG 患者的潜在益处 (NCT04804709)。另一项 1 期研究正在检验使用 FUS 打开接受口服依托泊苷的儿科 DMG 患者 BBB 的可行性 (NCT05762419)。 后,一项正在进行的声动力疗法联合 MRI 引导的 FUS (NCT05123534) 的 2 期研究已经招募了 37 名患者。
5.2. 纳米粒子
纳米粒子 (NP) 是尺寸从 1 到 100 纳米的小结构。它们大致可分为三个亚类:聚合物、无机和脂质基。NP 可以封装药物,提高其内容物的稳定性、溶解度和运输潜力。这些模块化结构还可以经过设计,以更好地穿透生物屏障(包括 BBB),从而促进药物向脑部的输送。FDA 已批准多种 NP 制剂用于输送化疗药物,应用于急性髓系白血病、胰腺癌、转移性乳腺癌等。值得注意的是, NP 制剂在脑癌治疗中面临着重大的转化挑战,主要是因为难以达到足够的肿瘤内药物浓度。因此,NP 封装疗法可能受益于有助于绕过 BBB 的机制,包括 CED、FUS 和 IA 给药。
NP 化疗制剂正在儿童脑癌临床前模型中得到积极研究。Pox-Palbo 是 CDK4/6 抑制剂 palbociclib 的 NP 制剂,经证实可改善该药物在脑中的药代动力学,并延长由 SHH 突变驱动的髓母细胞瘤小鼠模型的生存期。含有 vismodegib 的岩藻多糖基 NP 也取得了类似的效果。然而,仅靠这些 NP 不足以克服髓母细胞瘤模型中的治疗耐药性,这凸显了采用组合疗法的必要性。
NP 药物制剂在 DMG 中也显示出一些前景。早期研究表明,载有 DNA 修复抑制剂的 NPs 的 CED 可在 DMG 大鼠模型中诱导放射增敏。Shargh 等人开发了一种 N(3)-炔丙基 TMZ 衍生物 (N3P) 用于 DMG 模型,因为 DMG 肿瘤通常对 TMZ 疗法有抗药性。当 N3P 被包装到脱铁铁蛋白纳米笼或脂质体中并通过 CED 递送时,可在体外抑制 DMG 生长。此外,与游离 89Zr 相比,用锆-89 标记的载药 NPs 在大鼠脑内分布/保留得到改善。 后,伊立替康、CPT-11 及其活性代谢物 SN-38 的脂质体制剂经鼻腔给药可减缓小鼠 DMG PDX 模型中的肿瘤生长并延长生存期。由于这些有希望的临床前数据,NPs 在 DMG 中的治疗应用 近已开始临床试验。一项研究 NP 基帕比司他 (MTX110) 通过 CED 治疗 DMG 患者的 1 期研究 (NCT04264143) 于 2023 年 12 月结束,该化合物的其他 1 期试验正在进行中 (NCT05324501 和 NCT04264143)。
6. 未来方向
尽管付出了巨大的努力,但 100 多项 DMG 治疗方法的临床试验未能证明其具有显著的生存获益。姑息放射治疗仍然是 有益的干预措施。尽管许多靶向药物在体外甚至体内 DMG 模型中都显示出良好的治疗效果,但 DMG 的侵袭性、完整的 BBB/BBTB、免疫衰老和化疗耐药性共同破坏了人体试验的成功。将临床前成功转化为临床疗效的挑战是多方面的。DMG 明显的解剖位置和弥漫性浸润性生长模式带来了重大障碍。此外,临床前模型和人类患者之间肿瘤大小、药物渗透性和药物外排的差异,以及毒性问题,都限制了新型 DMG 疗法成功转化为临床应用。认识到与临床前模型相比,儿童 DMG 面临的独特障碍对于指导未来的药物开发计划至关重要。应对这些治疗挑战的策略可能包括联合药物治疗、同时使用多种治疗类型以及在治疗过程中破坏血脑屏障。
虽然各种研究表明立体定向活检对于选定的 DMG 患者来说是安全且有价值的诊断工具,但仍需要侵入性更小且更安全的方法来诊断和监测 DMG,尤其是在疾病和治疗监测方面。对血液、脑脊液或尿液等生物流体中的各种生物标志物的分析已在不同疾病中越来越受欢迎。这些所谓的液体活检已显示出对 DMG 的巨大潜力。考虑到 DMG 的位置微妙及其选择性 BBB/BBTB,DMG 生物标志物的浓度在脑脊液中高于患者血浆,使脑脊液成为 DMG 患者 有用的液体活检,尽管正在进行的研究正在调查血浆作为 DMG 液体活检的效用。可以通过液滴数字 PCR 测量和量化脑脊液和血浆中 DMG 衍生的 H3K27M 突变循环肿瘤 DNA (ctDNA) 和变异等位基因部分 (VAF)。研究表明 H3K27M 突变 ctDNA 在评估肿瘤生长和治疗反应方面的效用。研究已成功测试了 H3K27M ctDNA VAF 在接受 ONC201 治疗的 DMG 患者中用于治疗监测的效果。未来的研究将为液体活检在 DMG 中的应用提供更多见解,不仅可用作诊断工具,还可用作更好地研究 DMG 的工具。
7. 结论
DMG 是儿童脑肿瘤相关死亡的主要原因,迫切需要改善患者及其家属的治疗结果。这种普遍致命的恶性肿瘤具有固有的治疗耐药性、弥漫性侵袭关键的中枢神经系统结构以及相对完整的 BBB/BBTB 带来的挑战。这些特征共同构成了有效疗法开发的巨大障碍,新的治疗策略应寻求专门解决这些独特挑战。目前在应对这些挑战方面取得的进展体现在努力通过突破 BBB/BBTB 和探索新的药物包装方法来改善药物输送。结合不同的治疗途径和评估靶向疗法是很有前途的策略,也是转向创新 DMG 治疗策略的关键组成部分。通过我们对 DMG 生物学及其分子特征的理解不断进步,未来的研究将能够评估更具体和更有针对性的疗法。通过采用创新的治疗方式、克服 BBB 障碍和/或探索新的药物包装方法,我们希望为正在应对 DMG 毁灭性影响的患者和家庭提供谨慎乐观的态度。


 医无忧服务热线:
医无忧服务热线:
