 400-028-6288
400-028-6288 在线客服
在线客服
 官方微信
官方微信
 400-028-6288
400-028-6288 在线客服
在线客服
 官方微信
官方微信

新闻动态
必妥维Biktarvy美国获批治疗耐药性的HIV感染者
美国疾病控制和预防中心(CDC)发表了一份《发病率和死亡率周报》(MMWR),其中描述了五例年轻、健康的男同性恋者的罕见肺部感染,卡氏肺囊虫肺炎(PCP)。当时,人们还不知道到导致该病的发病原因。
一年后,这种神秘的疾病有了一个名字:获得性免疫缺陷综合征,即艾滋病(AIDS),它破坏了免疫系统,使身体受到各种感染。
如今,艾滋病已是一项重要的公共卫生问题。
抗击艾滋四十载,新药迭代推出
1983年,科学家终于发现了导致艾滋病的病毒,并将其命名为人类免疫缺陷病毒(HIV)。此后,研究人员开启了针对该病毒的抗病毒疗法。
然而,事实证明,艾滋病毒在体内很难被杀死。这是因为,HIV病毒攻击的目标是辅助T细胞,这些细胞通常是人体细胞免疫的主要功能细胞。而且,HIV是一种逆转录病毒,它们擅长欺骗体内的宿主细胞,产生更多的拷贝,造成终身感染。
在首次报告HIV后的 个十年里, 个抗艾滋病药物,齐多夫定(AZT)上市了(1987年)。齐多夫定通过阻断病毒逆转录酶来发挥作用,可以显著延长艾滋病患者的生命。
在接下来的几年里,美国食品和药物管理局(FDA)批准了其他几种与AZT作用类似的药物,这些药物都属于核苷类逆转录酶抑制剂(NRTIs)。
然而,由于病毒变异,随着时间的推移,很多药物不再起作用了。到20世纪90年代初,HIV是25至44岁美国人的头号致死因素。因此,亟需新作用机制的抗病毒药物。
1995年,FDA批准了沙奎那韦,它是 个获批的HIV蛋白酶抑制剂。一年后又出现了另一类抗逆转录病毒药物,称为非核苷类逆转录酶抑制剂(NNRTI),例如奈韦拉平(Viramune)。这些药物为抗HIV综合治疗的新时代铺平了道路。
医生们开始使用沙奎那韦加上AZT或其他抗逆转录病毒药物的处方。这种综合疗法被称为高活性抗逆转录病毒疗法(HAART),即“鸡尾酒”疗法。
“鸡尾酒”疗法在1996年成为HIV治疗的新标准。HAART大大延长了艾滋病患者的寿命。但是,HAART需要每天服用许多种药。多次服药和药物的副作用使许多人放弃了HIV治疗。这促使了复方单片的开发。
1997年,FDA批准了一种二合一片剂,名为卡贝滋(Combivir)的药片。近年来,新的HIV药物类别不断涌现。今天,有30多种HIV药物可用。许多人每天只需吃一片药就能控制体内的艾滋病毒。
同类 优——Biktarvy成王
从 2021 年全球前十大 HIV 药品来看,销售额都在6亿美元以上, 高销售额的是吉利德于2018年推出的必妥维(Biktarvy, 比克恩丙诺),被认为是目前同类 优的抗逆转录病毒疗法(ART)+整合酶抑制剂为基础的鸡尾酒方案。
必妥维是一种完整的、单片的、一天一次的处方药,用于治疗体重成人患者和儿童患者的HIV-1病毒感染。它既可用于从未服用过HIV-1药物的患者,也可用于正在更换现有HIV-1药物的患者。
吉利德于2017年6月向美国FDA提交上市申请,于2018年2月获得美国FDA批准,其后陆续在欧盟、我国香港地区等全球多地获批。作为吉利德销售额 高的抗病毒产品之一,2021年,必妥维的销售额达到82.4亿美元,比2020年增长18.8%。2022年上半年,必妥维销售额继续增长,达到了47亿美元。到2025年,预计全球销售额将达到100亿美元。
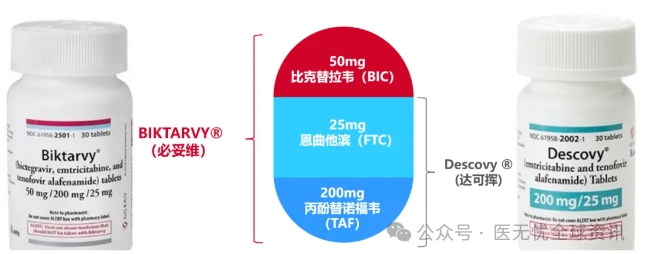
必妥维是一种三联复方单片制剂(BIC/FTC/TAF),活性成分包括比克替拉韦(BIC)/恩曲他滨(FTC)/丙酚替诺福韦(TAF)。其中,比克替拉韦(BIC)是FDA于2018年2月批准的一种新型整合酶链转移抑制剂(INSTI)。BIC已被证明能有效地抑制链式转移活性,其浓度与埃维他韦(EVG)和多鲁特韦(DTG)相似,但是,其独特的结构能 大限度地减少药物间的相互作用,增加蛋白质结合,并改善溶解度。
目前,BIC每天50毫克只能作为固定剂量与丙酚替诺福韦(TAF)每天25毫克和克恩曲他滨(FTC)每天200毫(BIC/FTC/TAF)的组合使用,即必妥维。
在两项研究关键的Ⅲ期临床试验中,在全部240周,使用必妥维治疗的研究中,超过98%的参与者达到并保持了检测不到的病毒载量(HIV-1 RNA<50拷贝/毫升)。 个试验是Gallant等人在欧洲、拉丁美洲和北美进行了一项多中心非劣效研究(1489号试验),参与者(n=629)被随机分配到必妥维或共同配制多鲁特韦/阿巴卡韦/拉米夫定(50/600/300 mg,DTG/ABC/3TC),以及配套的安慰剂,每天一次,持续144周。第二个Ⅲ期随机对照临床试验(1490试验)是Sax等人在645名参与者中评估了必妥维与DTG+F/TAF相比的非劣效性试验。
结果显示,必妥维在不同的成人群体中均起作用。在第48周,92.4%(n=290/314)服用必妥维的患者和93.0%(n=293/315)服用ABC/DTG/3TC的患者达到了HIV-1 RNA<50 c/ml的主要终点。在1490研究中,共有645名未接受治疗的成年艾滋病患者被1:1随机分配到必妥维或DTG+FTC/TAF。在第48周,89.4%(n=286/320)服用必妥维的患者和92.9%(n=302/325)服用DTG+FTC/TAF的患者达到了HIV-1 RNA<50 c/ml的主要终点。在随后的五年随访分析中,没有出现耐药性而导致的治疗失败,进一步证明了必妥维在治疗无效的成年人中治疗HIV-1的疗效和耐受性。
全球规模380亿美金
国内HIV药物市场快速增长
回到市场方面,根据弗若斯特沙利文的资料显示,全球HIV药物市场由2017年的325亿美元增长至2021年的380亿美元,复合年增长率为4.0%。预计2025年将达到479亿美元及2030年将达到575亿美元,2021年至2025年的复合年增长率为6.0%,而2025年至2030年的复合年增长率为3.7%。
在中国,根据弗若斯特沙利文的资料显示,2021年感染HIV的人口达到150万人,预计2025年将达到170万人,2030年将达到210万人。目前国内抗HIV用药市场规模在 30-40 亿元左右。患者基数增加、诊断率和治疗率提高、医保支付能力提升及自费人群的逐渐增加,将共同推动我国抗HIV用药市场规模的快速提升,预计2024年我国抗HIV药物市场规模将接近60亿元。
尽管发病人数逐年增长,市场规模增长迅速,但是,目前中国市场上的大部分HIV药物为单剂抗逆转录病毒药物,而不是在发达市场更容易获得的含有多种ART制剂的复合药物。国内HIV领域还缺乏国产创新药。
目前国内已经上市的国产创新药物有4款:前沿生物的艾博卫泰(于2018年获批)、 艾迪药业的艾诺韦林(于2021年6月获批)、真实生物的阿兹夫定(于2021年7月获批、有条件上市)、以及今年刚刚获批的艾迪药业的单片复方制剂艾诺米替(包含有艾诺韦林、替诺福韦和拉米夫定三种主要成分)。
总体说来,我国抗HIV药物开发与发达国家相比,差距巨大,尤其缺乏复合、长效抗HIV药物。但是,考虑到经济水平,患者支付能力、医保政策等因素,相信未来抗HIV药物开发方面会迎来一场变革。
(以下内容仅供参考,具体用药详情请谨遵医嘱)
必妥维-说明书
用法用量(具体用药详情请谨遵医嘱)
1、开始必妥维治疗和治疗期间的检测
在使用必妥维之前或开始使用时,对患者进行乙型肝炎病毒感染检测。
在使用必妥维之前或开始使用时,以及在使用必妥维治疗期间,应根据临床情况评估所有患者的血清肌酐、估计肌酐清除率、尿糖和尿蛋白。对于慢性肾病患者,还应评估血清磷。
2、成人和体重不低于25千克的儿童患者的建议用量
必妥维是一种三药固定剂量复方制剂,含有比特拉韦 (BIC)、恩曲他滨 (FTC) 和替诺福韦-阿拉非那胺 (TAF)。必妥维的推荐剂量为一片含50毫克BIC、200毫克FTC和25毫克TAF的药片,每天口服一次,可在进食或不进食的情况下服用:
a.成人和体重至少为 25 千克、肌酐清除率大于或等于 30 毫升/分钟的儿童患者;
b.接受长期血液透析的病毒学抑制成人,肌酐清除率估计低于15毫升/分钟。在血液透析日,在完成血液透析治疗后服用每日剂量的必妥维。
3、体重至少14千克至小于25千克的儿童患者的推荐剂量
必妥维的推荐剂量是一片含有30毫克BIC、120毫克FTC和15毫克TAF的片剂,随食物或不随食物口服,每日一次,服用方式如下:
a.体重至少14千克至小于25千克且估计肌酐清除率大于或等于30毫升/分钟的儿童患者。
对于无法吞咽整片药片的儿童,可将药片拆开,分别服用,只要在大约10分钟内吃完所有部分即可。
4、不建议肾功能严重受损的患者使用
患有以下疾病的患者不建议使用必妥维:
a.严重肾功能损害(估计肌酐清除率为15至低于30毫升/分钟);或
b.末期肾病(ESRD;估计肌酐清除率低于15毫升/分钟,且未接受慢性血液透析的患者;或
c.无抗逆转录病毒治疗史且正在接受慢性血液透析的ESRD患者。
5、不建议肝功能严重受损的患者使用
严重肝功能损害(Child-Pugh C 级)患者不宜使用必妥维。
不良反应
1、乙型肝炎严重急性恶化。
2、免疫重建综合征。
3、新发或恶化的肾功能损害。
4、乳酸性酸中毒/严重肝肿大伴脂肪变性。
注意事项
1、HIV-1和HBV合并感染患者的乙型肝炎严重急性加重
在开始抗逆转录病毒治疗前或治疗时,应对HIV-1病患者进行慢性乙型肝炎病毒(HBV)感染检测。
在与HIV-1和HBV合并感染且已停用含FTC和/或富马酸替诺福韦二吡呋酯(TDF)的产品的患者中,曾有发生乙型肝炎严重急性恶化(如肝功能代偿不全和肝功能衰竭)的报告,且可能在停用必妥维之后发生。应密切监测同时感染HIV-1和HBV而中断必妥维治疗的患者,包括临床和实验室随访,在停止治疗后至少持续几个月。如果适当,可能需要进行抗乙型肝炎治疗,尤其是在患有晚期肝病或肝硬化的患者中,因为肝炎治疗后恶化可能会导致肝功能失代偿和肝功能衰竭。
2、因药物相互作用导致不良反应或病毒学应答丧失的风险
必妥维与某些其他药物合用可能导致已知或潜在的显著药物相互作用,其中一些可能导致:
a.必妥维治疗效果丧失,可能产生耐药性。
b.伴随药物暴露量增加可能产生具有临床意义的不良反应。
了解预防或控制这些可能的和已知的显著药物相互作用的步骤,包括给药建议。在必妥维治疗之前和期间,考虑药物相互作用的可能性;审查必妥维治疗期间的合用药物;并监测伴随药物的不良反应。
3、免疫重建综合征
在接受联合抗逆转录病毒治疗的患者中,曾有发生免疫重建综合征的报告。在联合抗逆转录病毒治疗的初始阶段,免疫系统有反应的患者可能对惰性或残留的机会性感染[如鸟型分枝杆菌感染、巨细胞病毒、耶氏肺孢子虫肺炎(PCP)或结核病]产生炎性反应,这可能需要进一步评估和治疗。
也有报告称,自身免疫性疾病(如格雷夫斯病、多发性肌炎、格林-巴利综合征和自身免疫性肝炎)发生在免疫重建背景下;然而,发病的时间更易变,并且可能在治疗开始后许多个月发生。
4、新发或恶化的肾功能损害
已有含TAF产品上市后肾功能损害病例的报告,包括急性肾衰竭、近端肾小管病变(PRT)和范科尼综合征;虽然这些病例的大多数特征为可能导致所报告的肾脏事件的潜在混杂因素,但也可能这些因素使患者易发生替诺福韦相关的不良事件。严重肾功能损害(估计肌酐清除率为15至低于30毫升/分钟)、或ESRD(估计肌酐清除率低于15毫升/分钟)且未接受慢性血液透析的患者,或无抗逆转录病毒治疗史且正在接受慢性血液透析的ESRD患者,不建议使用必妥维。
服用替诺福韦前体药物的肾功能受损患者和服用肾毒性药物(包括非甾体抗炎药)的患者发生肾脏相关不良反应的风险增加。
在开始必妥维治疗之前或之时,以及在必妥维治疗期间,根据临床情况评估所有患者的血清肌酸酐、估计肌酐清除率、尿糖和尿蛋白。对于慢性肾病患者,还要评估血清磷。对于肾功能出现临床意义上的显著下降或有范科尼综合征证据的患者,停用必妥维。
5、乳酸性酸中毒/严重肝肿大伴脂肪变性
单独使用核苷类似物(包括必妥维的一种成份恩曲他滨和替诺福韦的另一种前药富马酸替诺福韦酯)或与其他抗逆转录病毒药物联合使用时,曾有发生乳酸性酸中毒和严重肝肿大伴脂肪变性的报告,包括出现致死病例。对于出现提示乳酸性酸中毒或明显肝毒性(可能包括肝肿大和脂肪变性,即使转氨酶没有显著升高)的临床或实验室检查结果的患者,应暂停必妥维治疗。
特殊人群用药
1、妊娠期
目前尚无足够的女性妊娠期使用必妥维的数据来说明药物相关的出生缺陷和流产风险。另一种整合酶抑制剂多罗替拉韦(Dolutegravir)与神经管畸形(NTD)有关。与有生育能力的人讨论使用必妥维的获益风险,尤其是在计划怀孕的情况下。在妊娠期间使用必妥维只在向APR报告的少数女性中进行了评估;因此,APR的BIC数据不足以充分评估重大出生缺陷的风险。使用含有TAF或FTC的其他药物产品治疗孕妇的报告有助于APR对这些成分进行总体风险评估。APR的现有数据显示,与美国大都会亚特兰大先天缺陷计划(MACDP)参考人群中2.7%的重大先天缺陷率相比,FTC或TAF的重大先天缺陷总体风险在统计学上没有显著差异。APR 中未报告流产率。据估计,美国普通人群中临床认可的妊娠流产率为 15-20%。
在一项产前/产后发育研究中,从妊娠第6天到哺乳/产后第24天,向妊娠动物口服BIC( 高300毫克/千克/天)。在从出生前(子宫内)到哺乳期每天暴露于母体和幼仔暴露量(AUC)的后代中,未观察到显著的不良作用,母体和幼仔暴露量(AUC)分别约是人暴露量的30倍和11倍(RHD)。
2、哺乳期
目前尚不清楚必妥维或必妥维的所有成分是否存在于母乳中、是否影响母乳产量或是否对母乳喂养的婴儿产生影响。根据已公布的数据,已显示FTC存在于人类母乳中。在哺乳期动物幼仔的血浆中检测到了BIC病,这很可能是由于乳汁中存在BIC,并且在TDF给药后,已显示在泌乳动物乳汁中存在替诺福韦。尚不清楚动物乳汁中是否含有TAF。
母乳喂养的潜在风险包括:(1)HIV-1传播给HIV-1阴性婴儿;(2)在HIV-1阳性婴儿中产生病毒抗性;(3)类似于在成人中所见的母乳喂养婴儿中的不良反应。
3、儿童使用
必妥维作为治疗体重至少为14千克的1型人类免疫缺陷病毒(HIV-1)感染儿童患者的全套方案,其安全性和有效性均已得到证实:
1)无抗逆转录病毒治疗史或
2)对于病毒学抑制(HIV-1 RNA低于50拷贝/毫升)、使用稳定的抗逆转录病毒疗法且对比特拉韦或替诺福韦没有已知或疑似耐药性的患者,用于替代当前的抗逆转录病毒疗法。
在体重至少为14千克的儿童患者中使用必妥维有以下依据:
1)成人试验
2)在三个年龄组的病毒抑制儿科受试者中进行的开放标签试验
队列1:12至18岁,体重至少35千克,接受必妥维治疗直至第48周(N=50),
队列2:6至12岁,体重至少25千克,接受必妥维治疗直至第24周(N=50),和
队列3:年龄至少2岁,体重至少14至小于25千克,接受必妥维治疗直至第24周(N=22)。未招募2岁以下的儿童受试者;在招募时年龄为3岁的6名儿童受试者中,3名受试者的体重在14至小于15千克之间。
在这些儿童受试者中,必妥维的安全性和疗效与在成人受试者中相似,必妥维各组分的暴露量在临床上没有显著变化。
尚未确定在体重小于14千克的儿童患者中使用必妥维的安全性和有效性。
4、老年用药
在病毒学抑制受试者中进行的临床试验(试验4449、1844和1878)包括111名接受必妥维治疗的65岁及以上受试者,其中包括86名来自开放标签、单臂试验的65岁及以上受试者,这些受试者从以前的抗逆转录病毒治疗方案转换为必妥维。在这些试验中接受必妥维治疗的患者总数中,100名(90%)为65至74岁,11名(10%)为75至84岁。未观察到老年受试者与18岁至小于65岁的成人之间在安全性或有效性方面的总体差异,且其他已报告的临床经验未发现老年患者与年轻患者之间的应答差异,但不能排除某些老年人具有更大的敏感性。
5、肾功能损害
在病毒学抑制的ESRD(估计肌酐清除率低于15毫升/分钟)成人慢性血液透析患者中,采用FTC+TAF联合埃替拉韦和cobicistat作为固定剂量复方片剂进行治疗,为期96周(N=55),在单臂、开放标签试验(试验1825)中评估了FTC和TAF(必妥维的组分)的药代动力学、安全性、病毒学和免疫应答。在试验1825的延长期,10名病毒学抑制的受试者转而接受必妥维治疗,所有受试者均保持病毒学抑制48周。
对于估计肌酐清除率大于或等于30毫升/分钟的患者,或接受慢性血液透析的病毒抑制成人(估计肌酐清除率低于15毫升/分钟),不建议调整必妥维的剂量。在血液透析日,在完成血液透析治疗后服用每日剂量的必妥维。
Cockcroft-Gault 法估计肌酐清除率低于30毫升/分钟的患者,或未接受慢性透析的ESRD患者(估计肌酐清除率低于15毫升/分钟),或无抗逆转录病毒治疗史且接受慢性透析的ESRD患者,不推荐使用必妥维,因为必妥维在这些人群中的安全性和/或疗效尚未得到证实。
6、肝功能损害
对于轻度(Child-Pugh类别A)或中度(Child-Pugh类别B)肝功能损害的患者,不建议调整必妥维的剂量。尚未在严重肝功能损害(Child-Pugh C类)患者中进行必妥维研究。
因此,不建议将必妥维用于严重肝功能损害患者。
禁忌症
1 孕妇应该避免使用必妥维。虽然该药物对于怀孕妇女的安全性并没有明确的相关研究结果,但基于动物研究的结果显示,必妥维可能对发育中的胎儿产生不良影响。因此,如果你正在计划怀孕或怀孕中,应该与医生咨询其他替代性药物。
其次,对于已知对必妥维中任何成分过敏的患者,禁止使用该药物。过敏反应可能导致皮肤瘙痒,皮疹,呼吸困难等症状。如果你有过敏史或对必妥维中的任何成分过敏症状,务必告知医生。
2 必妥维不应与某些其他药物一同使用。对于那些正在服用苯二氮䓬类适应症药物(如地巴唑和三唑仑)的患者,必妥维是禁忌的,因为这可能会导致令人困扰的副作用,例如嗜睡和局部过敏反应。
3 对于已经患有或可能患有乙肝病毒感染的患者,使用必妥维时需要特别小心。这是因为莫非伦,作为必妥维的成分之一,可能会增加乙肝病毒的活性,导致疾病进展。因此,如果你曾经接受过乙肝病毒治疗,或是有乙肝病毒感染的风险,请告知医生以便采取相应措施。
4 必妥维并不适用于所有年龄段的患者。该药物只用于18岁及以上的成年患者。对于儿童和青少年,需寻找其他适当的替代治疗药物。
总之,必妥维是一种重要的艾滋病治疗药物,但并不适用于所有患者。孕妇、对必妥维成分过敏的人、正在服用特定药物的人、接受乙肝病毒治疗或有乙肝病毒感染风险的人,以及未满18岁的患者都不适合使用必妥维。在使用该药物之前,请务必与医生进行详细咨询,了解自己的禁忌情况,并寻找适当的替代治疗方案。只有在医生的指导下正确使用药物,才能确保艾滋病治疗的安全和有效。
药物相互作用
1、其他抗逆转录病毒药物
因为必妥维是一个完整的方案,所以不建议与其他抗逆转录病毒药物联合用药治疗HIV-1感染。未提供关于与其他抗逆转录病毒药物潜在的药物间相互作用的全面信息,因为合用HIV-1抗逆转录病毒疗法的安全性和疗效未知。
2、必妥维对其他药物的潜在影响
BIC在体外可抑制有机阳离子转运体2 (OCT2) 和多药与毒素挤压转运体1 (MATE1)。与作为OCT2和MATE1底物的药物(如多非利特)同时服用必妥维,可能会增加这两种药物的血浆浓度。
3、其他药物对必妥维一种或多种成份的潜在影响
BIC是CYP3A和UGT1A1的底物。CYP3A的强诱导剂和UGT1A1的诱导剂药物可显著降低BIC血浆浓度,这可能导致必妥维疗效丧失和耐药性产生。
与CYP3A强抑制剂和UGT1A1抑制剂一起使用必妥维可能会显著增加BIC血浆浓度。
TAF是P-糖蛋白(P-gp)和乳腺癌耐药蛋白(BCRP)的底物。同时服用抑制P-gp和BCRP的药物可能会增加TAF的吸收和血浆浓度。诱导P-gp活性的药物联合给药预计会降低TAF吸收,导致TAF血浆浓度降低,这可能导致必妥维疗效丧失和耐药性产生。
4、影响肾功能的药物
由于FTC和替诺福韦主要通过肾小球滤过和主动肾小管分泌的组合由肾脏排泄,因此必妥维与降低肾功能或竞争主动肾小管分泌的药物联合用药可能会增加FTC、替诺福韦和其他经肾脏清除的药物的浓度,从而可能增加不良反应的风险。可通过肾小管主动分泌清除的药物包括但不限于阿昔洛韦、西多福韦、更昔洛韦、万乃洛韦、缬更昔洛韦、氨基糖苷类(如庆大霉素)和高剂量或多种NSAIDs。
5、已确定的和潜在的显著药物相互作用
下表列出了已确定或潜在具有临床意义的药物相互作用,并推荐了预防或管理策略。所述药物相互作用基于对必妥维、必妥维的成分(BIC、FTC和TAF)作为单独制剂进行的研究,或者是必妥维可能发生的药物相互作用。
a.表格不包括所有内容。
b.↑ = Increase, ↓ = Decrease.
c.对必妥维或其成分作为单独药物进行了药物相互作用研究。
d.CYP3A 和 P-gp 的强诱导剂,以及 UGT1A1 的诱导剂。
e.圣约翰草的诱导效力可能因制剂不同而有很大差异。
6、与必妥维无明显临床相互作用的药物
根据对必妥维或必妥维成分进行的药物相互作用研究,当必妥维与下列药物联用时,未观察到有临床意义的药物相互作用:乙炔雌二醇、依地帕韦/索巴韦、咪达唑仑、诺格估计、舍曲林、索巴韦、索巴韦/韦帕斯韦和索巴韦/韦帕斯韦/沃西拉普韦。
药物过量
尚无患者过量服用必妥维的数据。如果发生药物过量,应监测患者是否出现中毒症状。必妥维服用过量的治疗包括一般支持措施,包括监测生命体征和观察患者的临床状况。
血液透析治疗可在服用四氯化碳后1.5小时内开始的3小时透析期内清除约30%的四氯化碳剂量(血流量为400毫升/分钟,透析液流量为600毫升/分钟)。目前尚不清楚腹膜透析能否清除四氯化碳。

血液透析可有效去除替诺福韦,提取系数约为54%。
成分
活性成分:比替拉韦、恩曲他滨和替诺福韦酰胺。
非活性成分:十碳纤维素钠、硬脂酸镁和微晶纤维素。
薄膜包衣:氧化铁黑、氧化铁红、聚乙二醇、聚乙烯醇、滑石粉和二氧化钛。
必妥维价格
原研药价格:
必妥维的原研药厂家是美国吉利德科学公司。在我国,原研药必妥维的价格大约为3680元/盒。医院和药店的价格可能在1200元左右一盒,但具体价格请以实际购买时为准。
仿制药价格:
仿制药价格很低,目前厂家来自印度、老挝、孟加拉等等。如有需要请扫描下方二维码添加客服微信获取报价单。
在了解了必妥维的原研与仿制药之别后,您是否也对这抗癌药物有了更深的思考?是价格与效果的权衡,还是个人情况的考量?快来分享您的见解吧,让我们共同探讨必妥维为患者带来的希望与挑战!
免责申明:本文章中内容仅供一般参考,不可直接作为决策内容,不对任何主体因使用本文内容而导致的任何损失承担责任。


 医无忧服务热线:
医无忧服务热线:
