 400-028-6288
400-028-6288 在线客服
在线客服
 官方微信
官方微信
 400-028-6288
400-028-6288 在线客服
在线客服
 官方微信
官方微信

新闻动态
Kirsten 大鼠肉瘤病毒致癌基因同源物 ( KRAS ) 是人类癌症中突变频繁的致癌基因。在结直肠癌 (CRC) 中,超过 50% 的病例存在KRAS突变,多达 4% 的患者发生KRAS密码子 12 的甘氨酸到半胱氨酸突变 ( KRAS G12C )。与非 G12C 突变相比,这种突变与标准化疗的短期反应和更差的总生存期相关。近年来,几种KRAS G12C 抑制剂已显示出临床活性,尽管所有患者终都出现了进展。通过 EGFR 受体负反馈的识别导致了 KRAS 抑制剂加抗 EGFR 组合的开发,从而增强了抗肿瘤活性。目前,几种 KRAS G12C 抑制剂正在开发中,I 期和 II 期临床试验的结果令人鼓舞。此外,第三阶段 CodeBreaK 300 试验证明了 sotorasib-帕尼单抗优于曲氟尿苷/替吡嘧啶,为携带KRAS G12C 突变的结肠直肠癌患者建立了新的治疗标准。其他组合,如 adagrasib-西妥昔单抗、divarasib-西妥昔单抗或 FOLFIRI-帕尼单抗-sotorasib 也显示出有意义的缓解率,目前正在评估中。尽管如此,这些患者中的大多数终都会复发。在这种情况下,液体活检成为表征耐药机制的重要工具,主要包括 MAPK 和 PI3K 通路的获得性基因组改变和酪氨酸激酶受体改变,但也有描述基因融合、组织学变化或激酶构象变化。在本文中,我们回顾了 KRAS G12C 抑制剂在结肠直肠癌中的发展以及主要的耐药机制。
1. 简介
Kirsten 大鼠肉瘤病毒致癌基因同源物 ( KRAS ) 是人类癌症中常见的突变致癌基因。在结直肠癌 (CRC) 中,超过 50% 的病例存在KRAS突变。针对KRAS突变型结直肠癌的推荐骨干治疗包括以氟嘧啶为基础的方案联合奥沙利铂和/或伊立替康,并在一线和二线中添加抗 VEGF。由于 EGFR 抑制剂的临床活性有限,不建议在RAS突变型 CRC 中使用。除了二线药物外,曲氟尿苷/替吡嘧啶(-TAS-102-,是细胞毒性核酸类似物曲氟尿苷和胸苷磷酸化酶抑制剂替吡嘧啶的组合)、瑞戈非尼(一种口服多激酶抑制剂,可阻断 VEGFR1-3、KIT、RET、RAF1、BRAF、PDGFR 和 FGFR)以及近的 TAS-102-贝伐单抗组合均已证明具有临床益处,并被视为标准治疗方法。然而,并非所有患者在难治性环境中都对此类治疗有反应,总体生存率仍然很差。RAS 突变对预后的影响已经得到充分证实,与具有RAS/BRAF野生型特征的肿瘤相比,其总体生存率更差。在结直肠癌中,多达 4% 的患者发生KRAS第 12 个密码子的甘氨酸突变为半胱氨酸突变(KRAS G12C),并且与接受化疗的一线和二线治疗时的总生存期 (OS) 较差有关。此外,在接受 TAS-102 治疗的难治性患者中, KRAS G12C 突变是 TAS-102 治疗总生存期获益降低的生物标志物 。事实上,一线和二线KRAS G12C 肿瘤患者的中位总生存期 (mOS)分别为 16.1 个月和 9.7 个月,而非G12C KRAS突变肿瘤患者的 mOS一线和二线分别为 18.3 个月和 11.4 个月。
结直肠癌中常见的KRAS突变是 G12D 突变,在多达 42% 的结直肠肿瘤中可发现。与其他 G12 和 G13 突变体相比,G12D 突变已被证实具有中等内在和 GAP 介导的 GTP 水解速率,而 G12A 等突变显著降低了内在水解,G12C 则表现出野生型水平。与其他KRAS突变相比, KRAS G12D 突变已被证实能以组织特异性方式引发不同的基因和蛋白质表达谱。
重要的是,KRAS G12C 蛋白在“开启”状态(其中附着一个鸟苷三磷酸 (GTP))和“关闭”状态(其中 GTP 失去一个磷酸基,变成鸟苷二磷酸 (GDP))之间循环。在活性状态下,KRAS 会增加下游致癌信号转导和细胞生长。G12C 突变会损害 GTP 水解,从而使 KRAS 转变为活性 GTP 结合状态,促进肿瘤发生和转移。这种动态构象变化暴露出一个可用特定抑制剂靶向的口袋。事实上,在过去几年中,几种 KRAS G12C 抑制剂,包括 adagrasib、sotorasib 和 divarasib 等,已被开发为单一疗法或与抗 EGFR 药物联合使用,并表现出有意义的临床活性。目前正在开发可增强抗肿瘤功效和克服获得性耐药性的新型组合。在本文中,我们回顾了 KRAS 抑制剂在转移性结直肠癌中的发展、已经描述的耐药机制以及克服这种耐药性和增强抗肿瘤作用的新组合。
2. RAS通路和下游信号
RAS 蛋白是一种小型的膜结合鸟苷酸结合蛋白,参与多种信号通路,终调节各种癌症类型的细胞生长、运动、血管生成和存活。它们与肿瘤进展和靶向治疗耐药性有关。在生理条件下,RAS 在两种构象状态之间转换:一种是活性状态,活性鸟苷-5'-三磷酸 (GTP) 附着在 RAS 蛋白上;另一种是非活性状态,GTP 被加工成鸟苷二磷酸 (GDP)。RAS 激活的初始步骤涉及几种受体酪氨酸激酶 (RTK) 的激活,由 RTK 胞外域中的配体结合诱导。这会导致 RTK 二聚化和自身磷酸化。然后,激活的受体与生长因子受体蛋白 2 (GRB2) 相互作用,募集鸟苷酸交换因子 (GEF),包括 Son of Sevenless 同源物 (SOS)。SOS 促进 GDP/GTP 交换,诱导构象变化从而激活激酶。这种激活会触发不同的途径,包括 RAF/MEK/ERK、PI3K/AKT/mTOR 以及参与细胞存活和转移的核转录因子。RAS 循环终被 GTP 酶激活蛋白 (GAP) 关闭,GAP 会诱导 GTP 水解,形成无活性的 RAS-GDP。G12C 突变发生在KRAS基因的第 12 位,其中甘氨酸 (G) 被半胱氨酸 (C) 氨基酸取代。该突变导致产生功能改变的突变 KRAS 蛋白,但仍保持组成活性。在这种情况下,Ostrem 等人在突变半胱氨酸的开关 II 区下方发现了一个变构口袋。G12C 抑制剂优先与 GDP 结合构象的 RAS 结合,阻断与 GTP 的交换,从而阻止信号级联的激活。图 1显示了与 KRAS G12C 抑制相关的 Ras 信号通路和药物。
3. KRAS G12C 抑制剂的开发
KRAS G12C 抑制剂的出现代表了该人群的一种新的治疗策略。除了开发几种抑制剂外,还发现了前期和获得性耐药机制,并制定了一些策略来克服这种耐药性。
3.1. KRAS 抑制剂单药治疗
3.1.1.索托拉西布
在发现与处于非活性 GDP 结合状态(关闭)的 KRAS G12C 开关 II 口袋共价结合的化合物以及了解 KRAS G12C 抑制机制后,sotorasib (AMG510) 得到开发,并于 2018 年作为同类首创抗 KRAS G12C 药物进入临床。在 I/II 期 CodeBreaK 100 试验中,I 期队列入组了129 名患有先前接受过治疗的携带KRAS G12C 突变的晚期实体瘤患者。其中 42 名患者接受过大量既往治疗。共有 25 名患者接受了 960 mg qd(源自拉丁语“quaque die”,即每天一次)的扩展剂量,随后该剂量被确定为 II 期试验的推荐剂量(RP2D)。没有发生剂量限制性毒性作用,也没有发生导致死亡的治疗相关不良事件。常见的治疗相关不良事件 (TRAE) 是腹泻、疲劳、恶心和天冬氨酸或丙氨酸氨基转移酶升高,分别发生在总人群的 30%、23%、21%、13% 和 12% 中。关于抗肿瘤活性,42 名 mCRC 患者中有 3 名(7.1%)有缓解,所有缓解都发生在接受 960 mg qd 剂量治疗的队列中。所有 mCRC 患者的疾病控制率 (DCR) 为 73.8%,960 mg qd 队列为 80%。CodeBreaK 100 试验的后续 II 期队列包括 62 名平均既往接受过三线治疗的患者。这些患者接受了 960 mg qd 的 sotorasib 治疗。近 2 年后,仍有 5 例患者接受治疗,客观缓解率 (ORR) 为 9.7%,66% 的患者肿瘤缩小,82% 的患者 DCR。中位无进展生存期 (mPFS) 为 4 个月。6 例患者 (10%) 出现了 3 级 TRAE;腹泻、疲劳、恶心和转氨酶升高被证实是常见的。观察到的 4 级事件是血肌酐磷酸激酶升高。除了安全和可耐受外,sotorasib 单药治疗在 mCRC 中仅表现出适度的抗肿瘤活性,尤其是与其他组织学如 NSCLC 相比时,sotorasib 单药治疗实现了 41% 的 ORR 和 6.3 个月的 mPFS。表 1总结了评估 KRAS G12C 抑制对KRAS G12C 突变结直肠癌患者的临床试验。
3.1.2.阿达格拉西布
KRAS G12C 抑制剂 adagrasib (MRTX849) 可不可逆地选择性地与非活性状态下的 KRAS G12C 结合。在 I/Ib 期 KRYSTAL-1 试验中,25 名患有晚期、既往接受过治疗、携带KRAS G12C 突变的实体瘤患者入组,并接受不同扩增剂量的治疗,其中 4 例患有 mCRC,2 例接受 RP2D 治疗,每次 600 毫克,每日两次(源自拉丁语“bis in die”,即每日两次)。观察到与 sotorasib 一致的毒性特征,恶心(80.0%)、腹泻(70.0%)、呕吐(50.0%)和疲劳(45.0%)是接受 RP2D 治疗的队列中常见的 TRAE。常见的 3/4 级 TRAE 是疲劳(15.0%)。在药代动力学方面,adagrasib 的半衰期比 sotorasib 更长(23 小时对 5.5 小时),同时暴露剂量依赖性更高,能够穿透中枢神经系统。值得注意的是,接受 RP2D 治疗的两例 mCRC 患者中,有一名出现部分缓解 (PR),DOR 持续 4.2 个月。其他疗效数据来自 I/II 期试验 KRYSTAL-1,其中 44 名 mCRC 患者接受 adagrasib 600 mg bid 治疗,其中 19% 的患者实现 PR,mDOR 为 4.3 个月,mPFS 为 5.6 个月。
3.1.3.迪瓦拉西布
divarasib (GDC-6036) 的临床开发于 2020 年开始。与前代产品相比,divarasib 的效力提高了 5 到 20 倍,选择性提高了 50 倍。值得注意的是,在等效纳摩尔浓度下,与 sotorasib 和 adagrasib 相比,divarasib 对 KRAS G12C 的相对烷基化程度更高。此外,与其他两种药物相比,divarasib 可使非 KRAS G12C 蛋白在更高浓度下烷基化。在一项评估 divarasib 安全性的 I 期试验中,在入组的 137 名患者中,55 名被诊断为 mCRC。在总人群中,12% 出现了 3 级或更高级别的 TRAE,包括腹泻、天冬氨酸转氨酶升高、恶心、呕吐和疲劳。半衰期长达 17 小时。关于转移性结直肠癌 (mCRC) 患者疗效,29% 的患者出现完全缓解 (CR) 或 PR,包括 1 例 CR。重要的是,仅分析接受 400 mg qd RP2D 治疗的 39 名患者亚组时,ORR 和 mPFS 分别增加 36% 和 6.9 个月。所有部分缓解均伴有循环肿瘤 DNA (ctDNA) KRAS G12C 等位基因频率在 2 个周期后降低至 1% 以下。APC和TP53中同时发生的突变对缓解没有显著影响。对 16 名缓解患者的治疗前和治疗后 ctDNA 的分析显示,9 名患者发生了至少一种与 KRAS 抑制剂耐药性机制相关的基因组变异。这些改变包括RAS拷贝数增加或扩增、非KRAS G12C 突变、受体酪氨酸激酶 (RTK) 和丝裂原活化蛋白激酶 (MAPK) 通路成分改变(包括ERBB2和MET扩增)以及BRAF突变。相反,在以进展性疾病 (PD) 为佳反应的总人群中,有 25 名患者中有 6 名发现所有RAS基因中至少一种预先存在的突变,其中包括一名 mCRC 患者,在这 6 名患者中,非KRAS G12C 和KRAS G12C 突变的等位基因变异频率分别自适应性增加和减少。同样,使用 divarasib 后,NSCLC 和 CRC 之间的疗效终点存在显著差异,因为 NSCLC 患者的 ORR 更高,为 53.4%,mPFS 为 13.1 个月。
3.1.4. 其他抑制剂
两项 I 期临床试验 (NCT05005234、NCT05497336) 的汇总数据已公布,这两项临床试验在 45 名携带KRAS G12C 突变的 mCRC 患者中测试了 Fulzerasib (IBI351)。在 32 名可评估患者中,ORR 为 43.8% (14/32)。9 名患者 (20.0%) 出现了 3 级 TRAE,没有导致停止治疗或死亡的药物相关不良事件。,Garsorasib (D-1553) 单药治疗在接受过大量治疗的KRAS G12C 突变 CRC患者中表现出了深度临床活性和安全性。基于这一初步活性,在 II 期试验中评估了 Garsorasib 和西妥昔单抗的组合。该试验包括 40 名患者,其中 80% 接受过至少两线治疗。ORR 为 45%,DCR 为 95%。mPFS 为 7.6 个月,而 OS 数据尚不成熟。未报告 4/5 级 TRAE。
3.2. 增强抗肿瘤活性的一步:将 KRAS G12C 抑制剂与抗 EGFR 药物相结合
从一开始,在 sotorasib 试验的早期阶段,NSCLC 和 CRC 患者之间的疗效就出现了显著差异。令人印象深刻的是,报告的ORR 在 NSCLC 中为 41%,而在 mCRC 中为 9.7% (CodeBreaK 100)。Amodio 等人发现了细胞水平上的一些差异,特别是观察到结直肠癌细胞系表现出更高的磷酸化功能性受体酪氨酸激酶 (RTK) 基础水平,并保持对生长因子进一步激活 EGFR 的反应性。在这种并发机制的环境下,抑制KRAS G12C 不能抑制细胞生长和增殖。此外,与 NSCLC 细胞系相比,在 CRC 中抑制KRAS G12C 后,MAPK 通路的反弹更为明显。因此,在体外和结直肠患者模型中研究了KRAS G12C 抑制剂和抗 EGFR 疗法的协同组合,结果显示肿瘤显著消退甚至完全缓解。Rayan 等人进一步探索了对KRAS G12C 抑制剂的适应性耐药性,发现 MAPK 通路的反弹是主要机制。这种反弹的特点是显著诱导 GTP 结合形式的野生型 HRAS 和 KRAS,而 HRAS 和 NRAS 的敲低则会消除这种反弹,这种反弹导致 MAPK 通路以 KRAS G12C不依赖的方式激活,这表明无法通过增加KRAS G12C 抑制剂的剂量来克服它。相反,涉及上游和下游抑制的策略,特别是使用 SHP2 或 MEK 抑制剂,可在体外对 MAPK 信号产生强烈而持续的抑制。这项研究提出了一种替代方法,即KRAS G12C 抑制剂与靶向 RTK 信号的化合物的组合。这些结果为 KRAS G12C 抑制剂与帕尼单抗和西妥昔单抗以及 MAPK 通路上的其他抑制剂的联合使用铺平了道路,目前正在进行与KRAS G12C抑制剂联合使用的临床试验。
3.2.1. 阿达格拉西布 西妥昔单抗
在 I/II 期试验 KRYSTAL-1 中,还在 32 名患者中测试了阿达格拉西布与西妥昔单抗的联合用药效果。单药治疗组有 34% 报告了 3 级或更高级别的 TRAE,联合治疗组有 16% 报告了 3 级或更高级别的 TRAE,未观察到 5 级不良事件。然而,16% 接受西妥昔单抗治疗的患者因毒性而停药。联合治疗的毒性特征仅在西妥昔单抗相关不良事件方面有所不同,未观察到任何协同毒性作用。值得注意的是,与阿达格拉西布单药治疗相比,接受阿达格拉西布和西妥昔单抗联合治疗的患者中,ORR 从 19% 增加到 46%,mPFS 为 6.9 个月。ctDNA 的探索性分析显示,联合治疗组在两个周期后KRAS G12C 突变等位基因的清除率高于单药治疗组(88% vs. 55%),这与不同的 ORR 相关。未发现反应与PI3KCA和TP53突变之间的关联。比较阿达格拉西布加西妥昔单抗与二线化疗的 III 期 KRYSTAL-10 试验已完成招募。
3.2.2.索托拉西布 帕尼单抗
sotorasib 与帕尼单抗联用也已被研究。Ib 期试验 CodeBreaK 101 的队列专门针对 mCRC 患者,包括一个由 8 名患者组成的剂量探索队列(用于确定 sotorasib 与帕尼单抗联用的 RP2D)和一个包括 40 名患者的剂量扩展队列。总计有 27% 的患者出现 3 级以上 TRAE,主要归因于帕尼单抗,包括皮疹 (6%)、痤疮样皮炎 (4%) 和低镁血症 (4%)。帕尼单抗导致治疗中断或减药的次数多于 sotorasib(29% 对 15%),但并未报告因治疗相关不良事件而停药。在探索性队列中,63% 的患者曾接受过 sotorasib 单药治疗,ORR 为 12%,DCR 为 80%。相反,在扩展队列(抗 KRAS 初治)中,ORR 和 DCR 分别较高,为 30% 和 92%,mPFS 为 5.7 个月。重要的是,该研究还评估了单侧性的影响,但未观察到基于原发肿瘤位置的反应差异。
III 期试验 CodeBreaK 300 在难治性环境中测试了两种不同剂量(960 毫克和 240 毫克,每日一次)的 sotorasib,均与帕尼单抗联合使用,并将结果与标准治疗(瑞戈非尼或三氟尿苷/替帕西普)进行了比较。尽管 RP2D 已设定为 960 毫克,每日一次,但由于其非线性药代动力学特性,仍测试了 240 毫克,每日一次的替代剂量 sotorasib。试验达到了其主要终点,证明了两种剂量的帕尼单抗和 sotorasib 组合在 PFS 方面优于 SOC [分别为 5.7 比 2.2 个月,HR 0.49(95% CI,0.30 至 0.80;p = 0.006)和 3.9 比 2.2,HR 0.58(95% CI,0.36 至 0.93;p = 0.03)]。各组之间的 ORR 也存在显著差异,其中接受 sotorasib 960 mg qd 和帕尼单抗治疗的患者中,CR/PR 的比例为 26%,接受 sotorasib 240 mg qd 和帕尼单抗治疗的患者中,CR/PR 的比例为 5.7%,接受瑞戈非尼或曲氟尿苷/替帕西普治疗的患者中,CR/PR 的比例为 0%。总体生存率数据尚不成熟。至于治疗相关事件,接受 sotorasib 和帕尼单抗联合治疗(剂量分别为 960 mg qd 或 240 mg qd)和 SOC 治疗的患者中,3 级或更高级别的 TRAE 发生率分别为 35.8%、30.2% 和 43%。瑞戈非尼-三氟尿苷/替帕西普常见的 3 级或更高级别的 TRAE 是中性粒细胞减少症 (23.5%)、贫血 (5.9%) 和高血压 (5.9%),而对于联合治疗,3 级或更高级别的 TRAE 是帕尼单抗相关痤疮样皮炎 (11.3%)、低镁血症 (5.7%) 和皮疹 (5.7%)。还研究了 sotorasib 和帕尼单抗与 FOLFIRI 联合治疗 33 例接受过治疗且至少接受过一线全身治疗的转移性结直肠癌。ORR 为 58%。观察到更多的 3 级或更高级别 TRAE,高达 45%,其中大部分是皮肤病。
3.2.3. Divarasib 西妥昔单抗
在 29 名患有KRAS G12C 突变的 mCRC患者中,还测试了 divarasib 与西妥昔单抗的联合用药效果,主要给药剂量为 400 mg qd 。患者先前至少接受过两线全身治疗,其中 5 名患者接受了 KRAS G12C 抑制剂治疗。联合用药和单药治疗发生 3 级或更高级别 TRAE 的概率相似 (11%)。然而,联合用药的毒性反应更为复杂,除了腹泻之外,还发生了脂肪酶升高、低镁血症、皮疹和其他抗 EGFR 相关毒性。报告了两例 4 级 TRAE:一例低镁血症,一例中性粒细胞减少症。在先前未接受过 KRAS G12C 抑制剂治疗的患者中,ORR 为 62.5%,mPFS 为 8.1 个月。值得注意的是,五分之三接受 KRAS G12C 抑制剂治疗的患者实现了 PR。CtDNA 分析显示KRAS G12C 变异等位基因频率 (VAF) 显著下降,77% 的患者在两个周期后 KRAS G12C VAF 低于 0.5%,其中一名患者病情稳定 (SD)。在疾病进展时,在 14 名患者中,有 13 名发现了可能与适应性耐药相关的获得性基因组变异;基因组变异与接受 divarasib 单药治疗的患者报告的基因组变异一致。
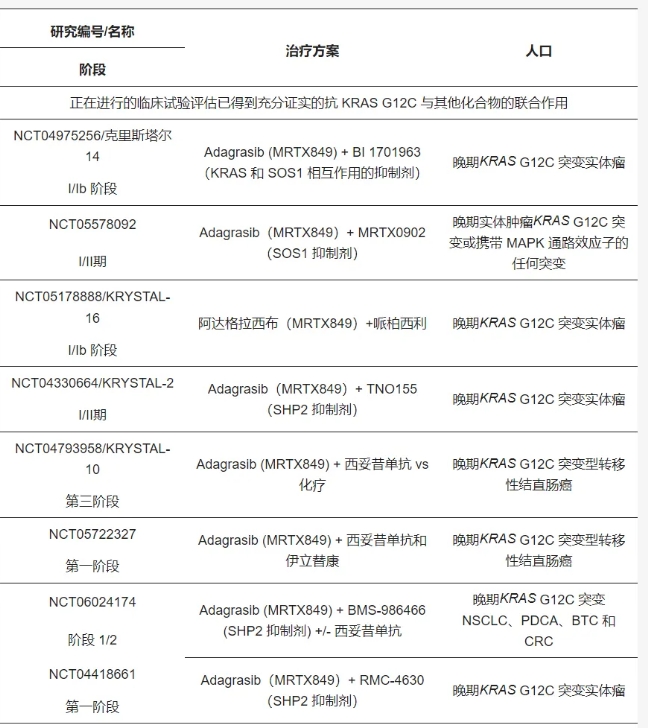
3.3. 正在进行的临床试验和结直肠癌中的新型 KRAS G12C 抑制剂
目前正在进行多项临床试验,研究现有和新型 KRAS G12C 抑制剂单独使用、与抗 EGFR 联合使用或与 MAPK 通路其他上游/下游调节剂的抑制剂联合使用的安全性和有效性。
一项 III 期临床试验正在对阿达格拉西布和西妥昔单抗的组合进行进一步研究,该试验将组合与二线治疗中的化疗进行比较(KRYSTAL-10)。一项 I 期试验正在评估将伊立替康添加到阿达格拉西布和西妥昔单抗中,以探索组合的安全性和活性(NCT05722327)。通过靶向 MAPK 通路的上游/下游效应物来增强 KRAS G12C 抑制也在评估中。正在评估的组合化合物靶向的主要 MAPK 通路效应物包括 SHP2(含 Src 同源区 2 的蛋白酪氨酸磷酸酶 2),这是一种由基因 PTPN11 编码的非受体型蛋白酪氨酸磷酸酶,作用于大多数受体酪氨酸激酶的下游,以及 SOS1(Sevenless 同源物 1 之子),这是一种将 RAS-GDP 转换为其活性构象状态的 GEF。同时抑制 SOS1 和 KRAS 在KRAS G12C 突变癌细胞的临床前模型中具有协同作用,目前正在 KRYSTAL-14 和其他试验(如 NCT05578092)中进行临床研究。同样,KRYSTAL-2、KontRASt-1、NCT05288205 和 NCT06024174 目前正在评估同时抑制 KRAS 和 SHP2,因为它在临床前模型中增强了 KRAS 抑制作用。此外,adagrasib 还在 KRYSTAL-16 中与 CDK4/6(细胞周期依赖性激酶 4/6)抑制剂 palbociclib 联合使用进行研究,因为它可以增强 KRAS 抑制,因为已知 KRAS 部分通过细胞周期蛋白 D 家族介导细胞增殖。在临床前模型中,同时抑制 KRAS 和 CDK4/6 可提高抗肿瘤活性。在临床研究中,与 garsorasib 联合使用的另一个假定联合抑制靶点是 MAPK 通路下游效应子 FAK(局部粘附激酶),这是一种促进肿瘤发生的非受体酪氨酸激酶。事实上,在临床前模型中发现其同时阻断效果优于抗 KRAS 单药疗法。
INTRINSIC 试验 (NCT04929223) 正在对 divarasib 和西妥昔单抗联合治疗,加上或不加上化疗进行研究,这是一项综合性试验,旨在评估多种靶向疗法在特定 mCRC 患者亚群(包括携带KRAS G12C 的患者)中的安全性和有效性。
已经开发了几种其他抗 KRAS G12C 化合物,目前正在进行 I 期试验测试,主要与抗 EGFR 疗法、抗 SHP2、抗 SOS1 或泛 RAS 抑制剂联合使用。这些化合物之间的药效学和药代动力学差异可能导致不同的疗效。例如,JDQ443 和 JNJ-74699157 与不同于其他 KRAS G12C 抑制剂的半胱氨酸残基相互作用。因此,这表明它们可能能够克服由已报道的靶标突变组成的耐药机制。相反,与其他 KRAS G12C 抑制剂相比,RMC 6291 具有独特而创新的作用机制:它与 cylophilin A 结合并形成二元复合物,然后在三级复合物中阻断 KRAS G12C 的 GTP 结合状态 (on),从而破坏 RAS 效应子结合并直接抑制 KRAS G12C (on) 信号传导。尽管它在离体模型中优于其他抗 KRAS G12C (off) 抑制剂,但仍需等待临床数据。表 2总结了正在进行的临床试验,评估 KRAS G12C突变结直肠癌患者对KRAS G12C 的抑制作用,表 3总结了 adagrasib、sotorsaib 和 divarsib 之间相关的差异。


 医无忧服务热线:
医无忧服务热线:
