 400-028-6288
400-028-6288 在线客服
在线客服
 官方微信
官方微信
 400-028-6288
400-028-6288 在线客服
在线客服
 官方微信
官方微信

新闻动态
Journal of Hematology & Oncology
IMJUDO/tremelimumab/曲美木单抗 中文说明书
RYBREVANT/amivantamab/埃万妥单抗 中文说明书
Imdelltra / tarlatamab 中文说明书
摘要
以免疫检查点抑制剂(ICI)为代表的癌症免疫疗法重塑了晚期非小细胞肺癌和小细胞肺癌的治疗模式。程序性死亡受体-1/程序性死亡受体配体-1(PD-1/PD-L1)和细胞毒性T淋巴细胞相关抗原-4(CTLA-4)是ICI中 常见和 有希望的靶点。与偶尔表现出治疗耐药性和疗效有限的ICI单药治疗相比,针对PD-1/PD-L1和CTLA-4的双重阻断免疫疗法在T细胞活化的不同阶段起作用,协同增强对癌细胞的免疫反应。这种新兴的双重疗法预示着癌症免疫治疗的新方向,然而,它在提高疗效的同时,可能会增加药物相关不良反应的风险。先前的临床试验已经探索了抗PD-1/PD-L1和抗CTLA-4药物在肺癌中的联合治疗策略,但其疗效仍不清楚,不可避免地会发生免疫相关不良事件。双特异性抗体的出现使得这种双重靶向变得更加可行,旨在减轻毒性而不损害疗效。因此,本综述重点介绍了针对 PD-1/PD-L1 和 CTLA-4 的双重阻断免疫疗法在治疗肺癌中的作用,并进一步阐明了其临床前机制和临床试验的当前进展。此外,我们还对双重阻断疗法与其他策略的潜在组合提供了新的见解,以优化未来肺癌的治疗模式。
介绍
肺癌主要起源于支气管粘膜或腺组织,是 常见的恶性肿瘤之一。2022 年,全球新发肺癌病例约为 248 万,占所有癌症的 12.4%,肺癌死亡率为 18.7%,是癌症相关死亡的主要原因。肺癌在组织学上可分为两种亚型:小细胞肺癌 (SCLC) 和非小细胞肺癌 (NSCLC)。NSCLC 是更常见的亚型,包括鳞状细胞癌、腺癌和大细胞癌等。另一方面,SCLC 是更具侵袭性的亚型,其特征是快速生长和极低的生存结果 。
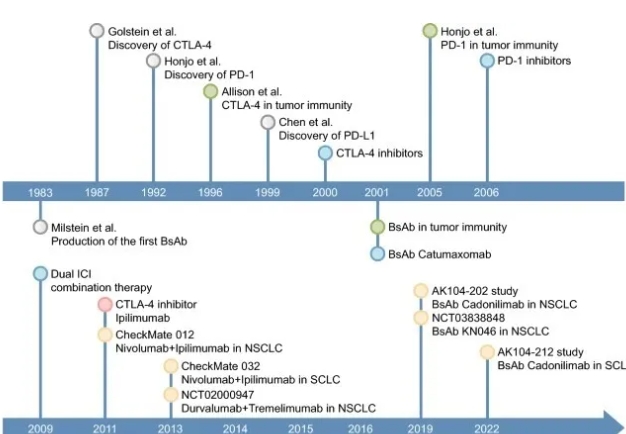
现今晚期非小细胞肺癌的治疗中,以铂类为基础的双药化疗仍为标准的一线治疗方案,而对于小细胞肺癌,铂类和依托泊苷联合治疗已成为传统的一线化疗方案,拓扑替康则作为二线治疗方案。化疗虽然对肺癌治疗有疗效,但却常常无法阻止病情的进展和复发,导致肺癌患者的生存率降低。近年来,免疫检查点抑制剂( ICIs )的发展显著改善了肺癌的预后。ICIs通过激活抗肿瘤免疫来杀死癌细胞,其中程序性死亡受体1/程序性死亡受体配体1(PD-1/PD-L1)和细胞毒性T淋巴细胞相关抗原4(CTLA-4)是 常见和 有前景的靶点,在肺癌的免疫治疗中发挥着至关重要的作用。然而,在接受 ICI 单药治疗的晚期 NSCLC 患者中,约有 20%-30% 的疗效有限。尽管它们在 SCLC 中显示出潜在疗效,但反应率相对较低。因此,基于 ICI 的联合免疫治疗方法,包括双重 ICI 联合治疗和双特异性抗体 (bsAbs),已成为肺癌治疗的新热点之一。 它们针对PD - 1 / PD - L1和CTLA - 4的历史总结在 1中。
本综述阐述了针对PD-1/PD-L1和CTLA-4的双重阻断免疫治疗在肺癌中的应用,全面概述了该背景下双重ICI联合治疗的应用和研究进展。此外,本文将探讨bsAb的出现和 新研究进展,这为肺癌免疫治疗带来了可观的前景。
PD-1/PD-L1和CTLA-4在肿瘤免疫中的作用
癌症免疫循环以及PD-1/PD-L1和CTLA-4的作用
癌症特有的基因和细胞改变为免疫系统产生了旨在识别和消灭癌细胞的 T 细胞反应提供了途径。为了有效地通过免疫介导的方式消灭癌细胞,需要启动癌症免疫循环,在非自身识别和预防自身免疫之间取得微妙的平衡。在这个循环中,树突状细胞 (DC) 捕获并处理肿瘤产生和释放的新抗原。该过程涉及促炎细胞因子等信号,这些信号对于引导免疫反应和避免对肿瘤抗原的外周耐受性至关重要。随后,DC 将这些抗原呈递给 T 细胞,从而触发和激活针对新抗原的效应 T 细胞反应。激活的效应 T 细胞随后迁移到肿瘤组织,通过其 T 细胞受体 (TCR) 与抗原肽主要组织相容性复合物 (pMHC) 之间的相互作用特异性识别并结合肿瘤细胞, 终导致肿瘤细胞的免疫破坏。这些肿瘤细胞的死亡会释放出更多的新抗原,从而使这一循环持续下去,并进一步增强反应的广度和深度。
然而,在癌症患者中,癌症免疫循环的功能通常不佳,因为肿瘤细胞通过抑制先天和适应性免疫系统的激活和效应功能来逃避免疫监视。例如,新抗原可能无法被识别或可能被误认为是自身抗原,而肿瘤微环境 (TME) 可能会抑制产生的效应细胞。癌症免疫疗法的出现为患者带来了一种新的模式,促进癌症免疫循环的重新激活、扩增和传播,同时 大限度地减少不受抑制的自身免疫炎症反应。在这些策略中,ICI 已成为恢复这一循环的关键。
PD-1/PD-L1抑制剂和CTLA-4抑制剂是肿瘤免疫检查点治疗中 先进的靶点之一,在免疫反应的不同阶段发挥作用。CTLA-4在T细胞活化初期高表达,与CD28竞争结合抗原呈递细胞上的CD80和CD86,向T细胞发出抑制信号,阻止其活化和效应功能。在免疫反应的后期,PD-1在活化的T细胞上表达。通过其配体PD-L1和PD-L2,它抑制T细胞受体介导的效应功能。在癌症免疫治疗中,ICIs通过靶向CTLA -4或阻断PD-1/PD-L1相互作用,可以恢复免疫活性,从而发挥抗肿瘤作用( 2A、B)。
然而,癌症免疫治疗的一个重大挑战是ICI治疗的耐药性,其中免疫耐受起着至关重要的作用。ICI耐药的机制分为肿瘤内在因素和肿瘤外在因素。内在耐药是指肿瘤细胞中参与免疫调节的基因发生组成性或获得性突变,从而影响免疫识别、细胞信号传导、基因表达和DNA损伤反应等过程。外在耐药与TME有关。TME由肿瘤外在因素组成,包括各种免疫细胞、基质细胞、血管系统、细胞外基质和影响治疗反应的细胞因子。由于免疫抑制和促炎细胞因子和介质之间的稳态受损,TME 中的动态相互作用常常导致髓系抑制细胞 (MDSC)、肿瘤相关巨噬细胞、M2 巨噬细胞和调节性 T 细胞 (Treg) 的浸润增加。TME中的免疫抑制细胞和抑制性细胞因子会削弱抗肿瘤免疫反应。例如,Treg 通过抑制性细胞因子和直接接触抑制效应 T 细胞 (Teff) 功能,从而促进自身耐受,从而限制炎症。已观察到 Treg 浸润到多种肿瘤类型中,这表明存在免疫抑制环境,由于无法增加 Teff 或减少 Treg,可能导致免疫疗法耐药性。此外,不断发展的免疫反应(从抗原呈递到癌细胞的细胞毒性和免疫记忆的形成)可促进抗肿瘤免疫的逃避。T 细胞无法增殖和多样化也可能导致 ICI 耐药性。
双重阻断免疫疗法的出现有效克服了免疫耐受,从而能够绕过耐药性。双重阻断免疫疗法的临床益处可能归因于互补机制。鉴于 PD-1/PD-L1 和 CTLA-4 在癌症免疫循环中的作用,CTLA-4 抑制剂可启动 T 细胞活化,而 PD-1/PD-L1 抑制剂则参与后期效应反应的重新激活。阻断两个靶点可以防止癌细胞逃避耗竭的 T 细胞免疫,同时向抗原呈递细胞 (APC) 传递信号,在早期激活 T 细胞,从而增强免疫反应。此外,已证明 CTLA-4 抑制剂可以消耗 TME 中的 Treg,并通过增强抗原识别来增强细胞毒性 T 淋巴细胞 (CTL) 介导的抗肿瘤免疫。双重阻断免疫疗法还有助于重塑免疫记忆,从而促进长期免疫反应。此外,PD-1/PD-L1 抑制剂和 CTLA-4 抑制剂没有交叉耐药性。因此,双重阻断免疫疗法比 ICI 单药疗法具有显著优势。
双重免疫检查点抑制剂联合治疗的机制
大量临床前模型一致证明,针对 CTLA-4 和 PD-1/PD-L1 的 ICI 可恢复 T 细胞对肿瘤细胞的识别和清除。1996 年,Leach 等人通过鼠肿瘤模型证明,CTLA-4 抑制剂可破坏通常会下调内源性 T 细胞反应的信号,从而激活通常无反应的 T 细胞。2007 年,Wong 等人 研究了 PD-1 抑制剂对人黑色素瘤抗原特异性 CD8 + CTL的体外扩增和功能能力的影响。他们发现 PD-1 阻断可增加 CTL 的频率和 数量,并增加能够通过脱颗粒识别黑色素瘤靶标的抗原特异性 CTL 的比例。此外,细胞因子分泌的动力学分析显示,PD-1 阻断还会增加培养物中 1 型和 2 型细胞因子的积累。
与单一 ICI 单药治疗相比,PD-1/PD-L1 与 CTLA-4 抑制剂联合使用不仅仅是起到加法的作用。Wei 等人报道,它们的协同作用明显超过单独使用时作用的总和。双重免疫检查点抑制剂的联合使用显著降低了耗竭表型细胞毒性 CD8 + T 细胞的比例,同时增加了活性效应 T 细胞的存在,包括活性 CD8 +和 CD4 +效应细胞( 2C)。免疫细胞群从耗竭 T 细胞转变为活性效应细胞,有可能显著增强整体免疫反应。Sun 等人证明 PD-1 和 CTLA-4 抑制剂联合治疗显著降低了小鼠模型中肿瘤复发和转移的风险,从而显著延长了生存期(p<0.05)。同样,Yeo 等人证明 PD-1 和 CTLA-4 抑制剂联合治疗显著降低了小鼠模型中肿瘤复发和转移的风险,从而显著延长了生存期(p<0.05)。观察到在小鼠模型中使用单一 T 细胞免疫球蛋白和 ITIM 结构域 (TIGIT) 抗体不会产生显著的抗肿瘤反应,但双重 ICI 治疗联合 PD-L1 抑制剂 Tecentriq 产生了明显的抗肿瘤作用。
Curran 等人在临床前小鼠模型实验中也报告了类似的结果。在预先植入 B16-BL6 黑色素瘤的小鼠中,接种 B16-Flt-3 配体(Fvax)与 CTLA-4 抑制剂联合使用可使 10% 的小鼠产生肿瘤排斥,而在 Fvax 中添加 PD-1 抑制剂可使 25% 的小鼠产生肿瘤排斥。CTLA-4 和 PD-1 ICI 联合使用可使 50% 的小鼠产生肿瘤排斥,疗效是单独使用任一 ICI 的两倍多。将 PD-L1 抑制剂加入该方案中可使 65% 的小鼠产生肿瘤排斥。此外,该研究表明,联合阻断 PD-1 和 CTLA-4 可增强 Teffs 的浸润,从而在肿瘤内产生非常有利的 Teffs 与 Tregs 比例。此外,通常处于失活状态的 CTLA-4 和 PD-1 阳性 T 细胞比例较高,但仍保持活跃。
鉴于这些结果和其他临床前研究,可以推断 CTLA-4 与 PD-1/PD-L1 相结合的双重 ICI 疗法可能优于单一 ICI 疗法,为后续临床试验奠定了坚实的基础。
双特异性抗体的作用机制
除了双重 ICI 联合疗法外,随着抗体工程技术的不断进步,结合相同或不同抗原上的两个不同表位的 BsAb 为癌症治疗提供了增强免疫力和降低毒性的替代方法。将多个特定靶点合并为一个抗体的概念可以追溯到 20 世纪 60 年代。Catumaxomab(抗CD3×抗EpCAM)是 个获批用于癌症治疗的 BsAb,随着 BsAb 的出现,它预示着癌症治疗新时代的开始。这种创新方法代表着通过提高特异性和疗效来优化癌症治疗的持续探索向前迈出了重要一步。
天然抗体由成对的重链 (H) 和轻链 (L) 组成,通常呈 Y 形构型。木瓜蛋白酶可以将它们分裂成两个功能片段,具体来说是 Fab 和 Fc 片段。Fab 片段包含抗原结合位点,而 Fc 片段促进与细胞和效应分子的相互作用。通过这种机制,天然抗体可以参与多种免疫过程,包括抗体依赖性细胞介导的细胞毒作用 (ADCC)、抗体依赖性细胞吞噬作用 (ADCP) 和补体依赖性细胞毒作用 (CDC)。然而,天然抗体的两个抗原结合位点是相同的,从而赋予其单特异性和双价特性。这种结构的一致性限制了它们免疫参与的范围,因此有必要探索在治疗应用中更加通用的抗体设计。
bsAbs 的出现解决了天然抗体固有的局限性。与天然抗体不同,bsAbs 只能通过生化或基因工程技术生产。它们由两种融合的单链抗体组成,根据 Fc 片段的存在与否可分为两类:免疫球蛋白 G (IgG) 样抗体和非 IgG 样抗体。TME 中充满了大量的免疫抑制细胞和配体,严重削弱了各种癌症免疫疗法的疗效。BsAbs 可以通过靶向多个免疫抑制检查点来缓解免疫抑制表型,有效绕过 TME 的免疫耐受性( 3)。此外,靶向共刺激分子的 bsAbs 可以增强 T 细胞介导的免疫反应。此外,bsAb 还具有独特的优势,既可以交联两种细胞,也可以在细胞膜上顺式结合两种分子。通过调整两个结合位点的亲和力,bsAb 可以帮助 大限度地减少正常组织中的脱靶效应,并有助于减少治疗相关不良事件 (TRAE)。这种双重靶向能力不仅扩大了其治疗潜力,而且还提供了更有针对性的治疗方法,减少了附带损害并提高了癌症治疗的特异性。
Pang 等人对靶向 PD-1 和 CTLA-4 的 bsAb Cadonilimab (AK104) 进行了临床前实验。该研究表明,由于采用四价设计,Cadonilimab 表现出高结合亲和力,尤其是在富含 PD-1 和 CTLA-4 的环境中,并且可以同时与表达 PD-1 和 CTLA-4 的不同细胞结合,与 ICI 相比表现出不同的活性。此外,与抗 PD-1 和抗 CTLA-4 的组合相比,Cadonilimab 可以通过增加白细胞介素 2 (IL-2) 和干扰素 γ (IFN-γ) 的分泌来激活 T 细胞。这些特性可能有助于降低 Cadonilimab 的毒性并增强其抗肿瘤活性。Jiang 等人在临床前小鼠模型试验中展示了 KN046 是一种靶向 PD-L1 和 CTLA-4 的 bsAb。导致肿瘤和脾脏中 CD3 + CD4 +和 CD3 + CD8 + T 细胞百分比显著增加,表明体内免疫反应强劲。此外,残留肿瘤成像显示用 KN046 治疗的小鼠黑色素瘤生长速度减慢,进一步证实了其抗肿瘤功效。这些临床前实验的结果为进一步推进 bsAb 临床试验提供了重要证据。
双重免疫检查点抑制剂联合治疗
目前,PD-1/PD-L1 与 CTLA-4 抑制剂联合的双免疫疗法已获批用于治疗多种癌症,如 nivolumab + ipilimumab 方案,即 PD-1 与 CTLA-4 抑制剂联合用药。此类抑制剂广泛应用于多种肿瘤类型的治疗,包括黑色素瘤、肾细胞癌 、结直肠癌、肝细胞癌、间皮瘤、食管鳞状细胞癌。具体来说, PD-L1 抑制剂 durvalumab 和 CTLA-4 抑制剂 tremelimumab 用于治疗肝细胞癌。在肺癌领域,双重ICI联合治疗也具有广泛应用的巨大潜力。
尼沃单抗与伊匹单抗联合使用
PD-1 和 CTLA-4 抑制剂的代表药物纳武单抗和伊匹单抗是多队列 I 期研究 CheckMate 012 (NCT01454102) 试验的重点研究对象。这项关键研究首次评估了双重 ICI 联合治疗对晚期 NSCLC 患者的疗效和安全性。研究对象被分为三组,每组接受三种不同给药方案中的一种:纳武单抗 1 mg/kg Q2W(每 2 周一次)+ 伊匹单抗 1 mg/kg Q6W,纳武单抗 3 mg/kg Q2W + 伊匹单抗 1 mg/kg Q12W,纳武单抗 3 mg/kg Q2W + 伊匹单抗 1 mg/kg Q6W。后两种方案是该试验的重点研究。在这两个队列中,所有接受治疗的患者(n=77)的客观缓解率 (ORR) 均为 43%,显著高于接受 nivolumab 单药治疗的患者(n=52)的 23% ORR。值得注意的是,在按 PD-L1 表达水平定义的亚组中,双重免疫疗法的 ORR 始终高于 nivolumab 单药治疗。此外,与双重免疫疗法相关的不良反应是可以耐受的,3-4 级 TRAE 分别为 37% 和 33%。该试验的结果表明,与之前的治疗方法相比,nivolumab 3 mg/kg Q2W 与 ipilimumab 1 mg/kg Q12W 或 Q6W 的联合治疗提供了更有希望的临床结果和更好的安全性。对于肿瘤 PD-L1 表达为 1% 或更高的患者尤其如此,为后续的 II 期和 III 期试验奠定了坚实的基础。
II 期临床试验 CheckMate 568旨在评估纳武单抗联合低剂量伊匹单抗在晚期 NSCLC 患者一线治疗中的疗效和安全性,并研究治疗效果与 PD-L1 表达和肿瘤突变负荷 (TMB) 之间的相关性。该研究纳入了 288 名初治晚期 NSCLC 患者,接受纳武单抗 3 mg/kg Q2W 联合伊匹单抗 1 mg/kg Q6W 治疗方案。结果显示,所有患者的 ORR 为 30%,PD-L1 表达 ≥1% 的患者的 ORR 为 41%,PD-L1 表达 <1% 的患者为 15%。无论 PD-L1 表达水平如何,TMB ≥10mut/Mb 的患者(n=48:PD-L1 ≥1%,48%;PD-L1 <1%,47%)与 TMB <10 mut/Mb 的患者(n=50:PD-L1 ≥1%,18%;PD-L1 <1%,5%)相比,ORR 和进展无生存期 (PFS) 均有所获益。然而,PD-L1 表达与 TMB 之间没有显著相关性。29% 的患者报告出现 3-4 级 TRAE,其中 常见的是胃肠道毒性 (5%)。这项试验再次证实了 nivolumab 和 ipilimumab 联合免疫疗法作为晚期 NSCLC 一线治疗的疗效和安全性。它还强调 TMB 是双 ICI 联合治疗疗效的潜在预测生物标志物,并评估了其阈值。
CheckMate 227 是一项开放标签 III 期临床试验,根据 PD-L1 表达(≥1% 或 <1%)对 IV 期或复发性 NSCLC 患者进行分类,并将其分配到研究的第 1a 部分或第 1b 部分。分层后,患者被随机分成三组。在第 1a 部分中,治疗方案包括 nivolumab 3 mg/kg Q2W 联合 ipilimumab 1 mg/kg Q6W、nivolumab 单药治疗或单纯化疗。在第 1b 部分中,治疗方案包括 nivolumab 3 mg/kg Q2W 联合 ipilimumab 1 mg/kg Q6W、nivolumab 加化疗或单纯化疗。2年随访结果显示,在第1a部分组(PD-L1表达≥1%)中,双ICI组和化疗组的中位总生存期(OS)分别为17.1个月和14.9个月(P=0.007),2年生存率分别为49%和11%。在第1b部分组(PD-L1表达<1%)中,双ICI组的中位OS比化疗组长近5个月(17.2个月vs. 12.2个月,HR=0.62)。亚组分析显示,TMB≥10 mut/Mb的患者接受双ICI联合治疗的ORR和PFS优于化疗组(ORR:45.3%vs. 26.9%,PFS:7.2个月vs. 5.5个月)。本研究进一步证实,虽然双免疫联合治疗的疗效与PD-L1表达无明显相关性,但高TMB表达者可能更能从双免疫联合治疗中获益。因此,该研究改变了PD-L1表达<1%患者的治疗前景,为晚期NSCLC的双免疫治疗开辟了新篇章。
除 NSCLC 外,目前还有多项临床试验正在评估 nivolumab 和 ipilimumab 双重免疫疗法在 SCLC 中的疗效和应用。CheckMate 032是一项多中心、多组、开放标签的 1/2 期试验,旨在评估 nivolumab 单药治疗以及 nivolumab 联合 ipilimumab 双重免疫疗法在经过一种或多种既往治疗(包括铂类化疗)后病情进展的 SCLC 患者中的安全性和疗效。该试验招募了 216 名 SCLC 患者,接受 nivolumab 3 mg/kg Q2W(n=98)单药治疗或 nivolumab 联合 ipilimumab 以不同方案(1 mg/kg 加 1 mg/kg(n=3)、1 mg/kg 加 3 mg/kg(n=61)或 3 mg/kg 加 1 mg/kg(n=54))Q3W 作为双重免疫疗法。试验结果显示,双免疫治疗的ORR和中位PFS(1mg/kg加1mg/kg:ORR 33%;1mg/kg加3mg/kg:ORR 23%,中位PFS 2.6个月;3mg/kg加1mg/kg:ORR 19%,中位PFS 1.4个月)总体优于nivolumab单药治疗(ORR 10%,中位PFS 1.4个月)。然而,与单药治疗相比,双免疫治疗也导致3/4级TRAE发生率更高。该试验证明了双免疫治疗在含铂化疗失败的SCLC患者中的有效性和可控的安全性,为这些治疗选择有限的患者带来了新的希望。
双盲 III 期临床试验 CheckMate 451 纳入了 834 名在一线铂类化疗期间未出现进展的广泛期小细胞肺癌 (ES-SCLC) 患者,以评估纳武单抗和伊匹单抗双重免疫治疗的疗效和安全性。患者被随机分成三组,每组接受纳武单抗 1 mg/kg 联合伊匹单抗 3 mg/kg 每三周一次治疗,共治疗 4 个周期,随后接受纳武单抗 240 mg 每两周一次维持治疗 (n=279)、纳武单抗 240 mg 单药治疗 (n=280) 或安慰剂治疗 (n=275)。试验结果显示,与安慰剂相比,双重免疫疗法和纳武单抗单药疗法均未显著改善 OS。双重免疫疗法组的 PFS 较安慰剂组略有改善(1.7 个月 vs. 1.4 个月,HR:0.72)。本研究提示,对于至少接受过一次铂类化疗后复发的SCLC患者,nivolumab和ipilimumab的双重免疫治疗可能有益,但作为维持治疗,并未达到预期疗效。
Durvalumab 与 tremelimumab 联合使用
对于 PD-L1 抑制剂和 CTLA-4 抑制剂的组合,durvalumab 加 tremelimumab 是 值得关注的治疗方案之一。durvalumab 是一种 PD-L1 单克隆抗体,可高亲和力和选择性阻断 PD-L1 和 PD-1 之间的相互作用,而 Tremelimumab 是一种针对 CTLA-4 的选择性人 IgG2 单克隆抗体。在 1b 期研究 (NCT02000947) 中,首次评估了 durvalumab 加 tremelimumab 双重免疫疗法对晚期 NSCLC 患者的疗效。本研究对 102 名未接受过治疗的晚期 NSCLC 患者实施了 durvalumab 加 tremelimumab 双重免疫疗法的递增剂量方案(durvalumab:3 mg/kg、10 mg/kg、15 mg/kg 或 20 mg/kg Q4W,或 10 mg/kg Q2W;tremelimumab:1 mg/kg、3 mg/kg、10 mg/kg Q4W)。试验确定,在 1 mg/kg 剂量的 tremelimumab 下,大多数 TRAE 均可控制,无需停止治疗。随着 tremelimumab 剂量的逐渐增加,TRAE 发生率有所增加,但临床疗效并未提高。在 102 名患者中,37 名 (36%) 出现严重 TRAE。研究表明,无论 PD-L1 表达如何,20 mg/kg Q4W 的 durvalumab 与 1 mg/kg Q4W 的 tremelimumab 联合使用均表现出可控的耐受性和抗肿瘤活性,为 III 期研究中的给药奠定了基础。
III 期 MYSTIC 研究进行了初步临床试验,以评估 durvalumab 联合 tremelimumab 双重免疫疗法对比标准化疗和 durvalumab 单药治疗在既往未接受过治疗的晚期 NSCLC 患者中的疗效。该研究招募了 1118 名既往未接受过治疗的患者,所有患者的体能状态 (PS) 均为 0–1,EGFR/ALK 为阴性,随后这些患者被随机分配到以下三组之一:durvalumab 20 mg/kg Q4W 单药治疗、durvalumab 20 mg/kg Q4W 联合 tremelimumab 1 mg/kg Q4W 治疗、或含铂双药化疗。研究表明,在 PD-L1 表达≥ 25% 的患者中,两种免疫疗法均未达到与化疗相比有显著生存获益的主要终点。此外,无论 PD-L1 表达如何,与单药治疗和化疗相比,双重 ICI 联合治疗在 PFS(HR:1.05,p=0.705)和 OS(HR:0.85,p=0.202)方面均未表现出显著的生存优势。然而,在亚组分析中,与单药治疗和化疗相比,bTMB ≥20 mut/Mb 的患者使用双重 ICI 联合治疗后 OS 显著改善(21.9 个月 vs. 12.6 个月 vs. 10 个月),这确定 TMB 是 durvalumab 加 tremelimumab 双重免疫治疗疗效的潜在预测生物标志物。
ARCTIC 是一项 III 期随机开放标签研究,评估了 durvalumab 联合 tremelimumab 双重免疫疗法对已接受至少两次全身治疗(包括至少一次铂类双药化疗)的晚期 NSCLC 患者的疗效。该试验由两项基于 PD-L1 表达(≥ 或 <25%)的独立子研究组成。子研究 B 将 469 名 PD-L1 表达 <25% 的患者随机分配接受 durvalumab 加 tremelimumab 双重免疫疗法、单药治疗加 ICI 或标准治疗。结果表明,与化疗相比,双重免疫疗法在中位 OS 方面显示出一些数值改善(11.5 个月 vs. 8.7 个月,HR 0.80,p=0.109),但中位 PFS 没有差异(均为 3.5 个月,HR 0.77,p=0.056)。
在 SCLC 患者中,durvalumab 和 tremelimumab 联合作为双重免疫疗法的探索取得了重大进展。一项 I 期临床试验评估了 durvalumab 加 tremelimumab 双 ICI 联合治疗在 ES-SCLC 患者中的安全性和临床活性。在该研究中,30 例患者被纳入扩展队列进行治疗, 初接受 durvalumab 20 mg/kg Q4W 联合 tremelimumab 1 mg/kg Q4W 治疗 7 个周期,随后每半年给药一次,共治疗 2 个周期,然后 durvalumab 10 mg/kg Q2W 治疗长达 12 个月。试验结果显示,中位 PFS 为 1.8 个月,中位 OS 为 7.9 个月,12 个月 OS 率为 41.7%。七名患者(23%)出现 3/4 级 TRAE,未因 TRAE 而停药,也未报告与治疗相关的死亡。该研究验证了 durvalumab 联合 tremelimumab 双重免疫疗法对 ES-SCLC 患者的良好活性和可耐受的安全性,为进一步的 II/III 期临床试验奠定了基础。目前正在进行的几项临床试验正在研究 durvalumab 加 tremelimumab 双重 ICI 联合疗法对 SCLC 患者的疗效(NCT03923270、NCT03043872)。此外,表1和表2列出了更多正在进行和已完成的 NSCLC 和 SCLC 双重 ICI 联合疗法临床试验。
双重 ICI 联合治疗的安全性和局限性
尽管有证据表明,双联 ICI 联合治疗在各种肿瘤类型中较 ICI 单药治疗或单纯化疗显著提高治疗效果,且在继发性耐药性改善、缓解延长、生存获益显著方面均有提高,但其安全性和局限性一直是人们持续关注和关注的焦点。虽然双联 ICI 联合治疗的安全性仍在可容忍的范围内,但包括 CheckMate 9LA 和 CheckMate 227在内的多项大规模临床试验显示,双联 ICI 联合治疗的 3/4 级 TRAE 发生率与对照化疗组相当甚至更高,尤其是在 3/4 级水平。III 期临床研究 CheckMate 9LA 显示,联合治疗组 3/4 级 TRAE 发生率为 47%,高于单纯化疗组(38%)。其中,CTLA-4 抑制剂的剂量被确定为影响安全性的主要因素之一,需要在降低剂量以确保安全性和增加剂量以确保疗效之间取得微妙的平衡。与双 ICI 联合治疗相关的 常见 TRAE 是皮肤病学(任何级别 34%,≥3 级 4.2%)、内分泌(23.8% 和 4.2%)、胃肠道(18.2% 和 2.4%)和肝脏(15.8% 和 8.2%)事件。此外,双 ICI 联合治疗中受益的人群似乎有限,多项临床试验表明, TMB和 PD-L1 等生物标志物阳性的人群具有更明显的生存获益,并且从这种方法中受益的肿瘤类型范围相对较窄。鉴于双重 ICI 联合治疗可能增加 TRAE 风险,与其他药物和治疗方式(如化疗、靶向治疗、放疗等)联合治疗的机会仍然非常有限,因为这可能会进一步增加 TRAE 的风险。
双特异性抗体
如先前研究表明,ICI 单药治疗临床疗效有限。相比之下,双联 ICI 联合治疗在提高生存获益的同时,也增加了 TRAE 风险,并且受到多种限制。bsAb 的出现为癌症治疗提供了一种新的选择,它既能提高免疫治疗的疗效,又能降低治疗相关的毒性。目前,多种 bsAb 被用于癌症免疫治疗,包括 blinatumomab (Blincyto)、Belantamab mafodotin (Blenrep)、teclistamab (Tecvayli) 和 mosunetuzumab (Lunsumio)。PD-1/PD-L1 和 CTLA-4 是 ICI 中 成熟的靶点之一,通过针对这些检查点的 bsAb 将其应用于肺癌免疫治疗,因此成为人们密切研究的焦点。这种方法提供了一种新颖且可能更有效的方法来利用人体的免疫反应对抗肺癌。总结了肺癌中 BsAb 的更多不同靶点
卡多尼利单抗(AK104)
卡多尼利单抗,也称为 AK104,是一种靶向 PD-1 和 CTLA-4 的人源化 bsAb。作为对称四价双功能抗体,它能同时以高亲和力结合肿瘤浸润淋巴细胞 (TIL) 上表达的 PD-1 和 CTLA-4,实现共靶向效应,从而增强抗肿瘤疗效和安全性。COMPASSION-01 (NCT03261011)是 探索卡多尼利单抗在实体瘤中的抗肿瘤疗效、耐受性和安全性的临床试验,包含剂量递增和扩展研究。该研究招募了 119 名晚期实体瘤患者,其中 39 名处于剂量递增 1a 期,80 名处于剂量扩展 1b 期;间皮瘤是 常见的肿瘤类型。试验中观察到的 常见的免疫相关不良事件(irAE)是输液相关反应,占18.5%,总体irAE和3/4级irAE分别发生在44.5%和6.7%的患者中。研究结果显示,总体缓解率为13.4%,中位缓解持续时间为12.9个月。该试验证实了卡多尼利单抗在晚期实体瘤患者中表现出良好的疗效和显著的耐受性。此外,该研究确定了卡多尼利单抗在后续II/III期试验中的推荐剂量为6 mg/kg Q2W。
1b/2 期 COMPASSION-03 (NCT03852251) 是一项多中心、开放标签临床试验,涉及 240 名实体瘤患者。在 1b 期研究的剂量递增阶段,患者接受 6 mg/kg 或 10 mg/kg Q2W 的卡多利单抗治疗。在剂量扩展阶段,患者接受 6 mg/kg 或 450 mg Q2W 固定剂量的卡多尼利单抗治疗。在该研究的 2 期部分,宫颈癌、食管鳞状细胞癌和肝细胞癌患者接受 6 mg/kg Q2W 的卡多利单抗治疗。共有 67 名患者 (28%) 出现 3/4 级 irAE。在 2 期临床试验中,宫颈癌、食管鳞状细胞癌和肝细胞癌患者的 ORR 分别为 32.3%、18.2% 和 16.7%。该试验证明了卡多尼利单抗在治疗晚期实体瘤方面的潜力及其可控的安全性,凸显了其作为癌症治疗新选择的前景。
在肺癌方面,AK104-202 研究是一项多中心、开放标签临床试验,评估了卡多尼利单抗治疗转移性 NSCLC 的疗效和安全性。该研究招募了 53 例患者,分为三组:A 组为铂类双药化疗失败并接受了免疫疗法 (IO) 的患者;B 组为铂类双药化疗失败且对免疫疗法产生原发性耐药的患者;C 组为铂类双药化疗失败且对免疫疗法产生获得性耐药的患者。所有患者均以 6 mg/kg Q2W 的剂量接受卡多利单抗治疗。遗憾的是,该研究未达到其主要终点,A、B、C 组的中位 OS 时间分别为 19.61个月、4.93 个月和 13.16个月。A组的ORR为10%,而B组和C组均未观察到反应。该试验表明,卡多尼利单抗对IO耐药患者,尤其是原发性耐药患者疗效有限。卡多尼利单抗在肺癌中的疗效和安全性仍有待进一步探索。目前,多项临床试验正在进行中,包括AK104-207(NCT04647344)和AK104-208(NCT04646330)(表3)。这些试验的结果有望揭示卡多尼利单抗在肺癌管理中的作用,并可能建立新的治疗方案范例
QL1706 (PSB205) 是一种双功能 bsAb,包含抗 PD-1 IgG4 和抗 CTLA-4 IgG1 工程化单克隆抗体。此外,还采用了新颖的 MabPair 技术平台,可以从单个宿主细胞生产两种与其天然形式非常相似的抗体,并作为单个产品生产。在 QL1706 中,每种抗体都经过了单独优化;例如,抗 CTLA-4 抗体具有更短的消除半衰期 (t 1/2),以 大限度地减少暴露并降低 irAE 风险。 项 I/Ib 期临床试验评估了 QL1706 对标准疗法失败的晚期实体瘤患者的疗效和安全性,共招募了 518 名患者。总体ORR为16.9%,中位缓解持续时间为11.7个月,其中NSCLC为14.0%,SCLC为23.1%。≥3级TRAE和irAE的发生率分别为16.0%和8.1%。试验还确定了QL1706的 大耐受剂量(MTD)为10mg / kg;在综合分析耐受性,药代动力学/药效学(PK / PD)和疗效后,建议的2期剂量(RP2D)为5mg / kg。该临床试验证实了QL1706在实体瘤中具有良好的抗肿瘤活性,特别是在NSCLC,鼻咽癌和宫颈癌患者中,表现出良好的耐受性。正在进行的随机 II 期(NCT05576272、NCT05179317)和 III 期(NCT05446883、NCT05487391)试验正在进行中,进一步的结果令人期待(表 3)。
针对 PD-L1 × CTLA-4 的 BsAb
KN046 是一种靶向 PD-L1 和 CTLA-4 的新型 bsAb,能够抑制 PD-L1 与 PD-1 之间以及 CTLA-4 与 CD80/CD86 之间的相互作用。临床前研究表明,KN046 可以介导 TME 中调节性 T 细胞的耗竭,从而增强抗肿瘤免疫反应并减少免疫抑制。KN046 的 I 期研究探讨了该药对晚期实体瘤患者的疗效、安全性和耐受性。该研究入组了 100 名患者,其中包括 59 名鼻咽癌患者和 36 名 NSCLC 患者。试验剂量递增期,根据改良毒性概率区间法,KN046的给药剂量为1、3、5 mg/kg Q2W、5 mg/kg Q3W、300 mg Q3W。剂量扩展期采用推荐剂量给药。14.0%的患者出现3/4级TRAE, 常见的TRAE为皮疹(33.0%)。试验结果显示总体ORR为12.5%,中位缓解持续时间为16.6个月。值得注意的是,CD8和PD-L1高表达的患者预后更好。该试验证实了KN046在晚期实体瘤中良好的疗效和耐受性,并为后续研究建立了5 mg/kg Q2W的RP2D。
II 期研究(NCT03838848)重点评估了 KN046 对铂类化疗失败或耐药的晚期 NSCLC 患者的疗效和安全性。研究共入组 64 例患者,分为队列 A(n=30)和队列 B(n=34),分别接受 KN046 3 mg/kg 和 5 mg/kg 静脉注射。结果显示,队列 A 和 B 的 ORR 分别为 13.3% 和 14.7%,两组的中位 PFS 均为 3.68个月;队列 A 和 B 的 OS 分别为 19.70个月和 13.04个月。然而,3/4 级 TRAE 的发生率为 42.2%。该试验证实,KN046的两种给药方案对于铂类化疗失败或耐药的晚期NSCLC患者均表现出良好的疗效和安全性。
针对其他抗原的 BsAb
除了前面提到的例子之外,bsAbs 作为下一代抗体疗法开发的关键方向,涵盖了一系列正在进行研究和临床试验的靶点。除了 PD-1/PD-L1 和 CTLA-4 等双免疫检查点之外,bsAbs 还靶向共刺激检查点,如 GITR、肿瘤相关抗原 (TAA),如 EGFR、生长因子(GF) 和细胞因子,包括 VEGF 和 TGF-β。靶点的多样性提供了广阔而有希望的研究前景。特别是对于肺癌患者,目前正在进行多项研究各种 bsAbs 的临床试验,如,以探索它们显著推进这种棘手疾病治疗前景的潜力。
CTX-8371由Compass开发,是一种靶向PD-1和PD-L1的双特异性抗体,具有2+2对称结构,采用通用轻链技术。它通过多种途径将PD-1阳性细胞转化为PD-1阴性细胞,从而增强抗肿瘤疗效。其I期临床试验(NCT06150664)目前正在实体瘤患者中进行,采用3+3剂量递增设计,剂量范围从0.1至10mg/kg,有5个剂量水平。AK112是一种靶向PD-1和VEGF的人源化IgG1双特异性抗体。其II期试验旨在评估AK112联合化疗对晚期NSCLC患者的疗效和安全性。试验结果表明,AK112 联合铂类双药疗法显示出良好的抗肿瘤活性和安全性,可作为无驱动突变的晚期 NSCLC 患者和既往 EGFR-TKI 治疗失败的 EGFR 功能性突变患者的一线治疗,以及既往全身铂类化疗和 PD-1/PD-L1 抑制剂治疗失败的晚期 NSCLC 患者的一线治疗。这为这些患者提供了一种宝贵的潜在治疗选择,该药物于 2024 年 5 月获批上市。埃万妥单抗是一种靶向 EGFR 和 MET 的双抗,临床研究表明其对 EGFR 外显子 20 插入的 NSCLC 患者有显著疗效。该药物已获得美国食品药品监督管理局 (FDA) 的加速批准,用于治疗外显子 20 插入的 NSCLC 的二线治疗,成为全球 针对该突变的靶向治疗药物。
对于小细胞肺癌患者,Tarlatamab 是一种靶向 delta 样配体 3 (DLL3) 和 CD3 的 bsAb。2023 年,一项涉及既往接受过治疗的小细胞肺癌患者的 II 期试验 (NCT05060016) 表明,每两周给药一次、剂量为 10 mg或 100 mg的 Tarlatamab 表现出抗肿瘤活性和持久的客观反应。此外,它还显示出良好的生存结果,10 mg组的 ORR 为 40%,100 mg组的 ORR 为 32%。10 mg组和 100 mg组的中位 PFS 分别为 4.9 个月和 3.9 个月。9 个月 OS 估计值在 10 mg组为 68%,在 100 mg组为 66%。此外,与 I 期试验相比,这项研究没有发现新的安全问题。基于这项临床研究的良好结果,FDA 于 2024 年 5 月 16 日迅速批准 Tarlatamab 作为 ES-SCLC 的创新疗法,适用于铂类化疗后疾病继续进展的患者。此次批准也标志着 SCLC 治疗领域引入了 针对 DLL3 的 bsAb。此外,针对 EGFR × c-MET 的 FPI-2068 (NCT06147037) 的临床试验正在进行中,更多针对 SCLC 中 DLL3 的 bsAb 等。
双重阻断免疫疗法疗效的生物标志物
随着免疫治疗的快速发展,寻找理想的生物标志物以精准预测治疗效果、确定 佳受益人群已变得日益重要。在双联ICI联合治疗中,PD-L1表达和TMB是目前研究 多的免疫治疗预测生物标志物。KEYNOTE-024 和 KEYNOTE-042 研究表明,PD-L1高表达(PD-L1 ≥ 50%)的患者在使用帕博利珠单抗治疗时表现出显著增强的抗肿瘤作用和更优的生存获益。然而,一些研究提出了相反的观点,例如CheckMate 227 和CheckMate 9LA 研究表明,无论PD-L1表达情况如何,双联ICI治疗和双联ICI联合化疗均比单纯化疗获得更显著的生存获益。因此,对于双重ICI联合治疗,PD-L1表达可能还不能作为预测疗效的全面、独立的生物标志物。与蛋白质生物标志物PD-L1不同,TMB是基因组生物标志物。TMB越高,表明肿瘤突变产生的新抗原越多,从而导致肿瘤浸润T淋巴细胞增多,从而增强肿瘤的免疫原性和针对肿瘤的潜在免疫反应。CheckMate 227 研究的亚组分析显示,在 TMB 高表达(≥10 个突变/Mb)患者中,Nivolumab + Ipilimumab 组和化疗组的中位 PFS 分别为 7.2个月和 5.5个月(HR=0.58,p<0.001),ORR 分别为 45.3% 和 26.9%,1 年 PFS 率分别为 42.6% 和 13.2%,这表明高 TMB 表达可能在选择从双 ICI 联合治疗中获益 多的人群方面具有预测作用。其他潜在的生物标志物包括微卫星不稳定性 (MSI)、错配修复缺陷 (dMMR)、4 基因炎症特征评分和肿瘤内CD8 + T细胞或TIL的浸润水平。
对于 bsAb,生物标志物的研究仍处于起步阶段。针对 PD-1 和 CTLA-4 的 bsAb Cadonilimab 的 I 期临床试验 COMPASSION-01 对生物标志物进行了探索性分析。在评估 54 例患者的错配修复 (MMR) 状态后,该研究发现,在 10 例具有 dMMR 状态的患者中,确认的 ORR 为 50%,中位 PFS 和 OS 分别为 15.5 和 20.5个月。相比之下,在 44 例具有熟练错配修复 (pMMR) 状态的患者中,确认的 ORR 为 6.8%,中位 PFS 和 OS 分别为 1.7 和 8.0个月。此外,该研究评估了 59 例患者的 PD-L1 表达情况,结果显示 PD-L1 肿瘤比例评分 (TPS) ≥1 的患者与 PD-L1 TPS <1 的患者相比,生存获益更高(ORR:28.6% vs 9.6%;疾病控制率 (DCR):85.7% vs 38.5%;中位 PFS:7.4个月 vs 1.9个月;中位 OS:15.2个月 vs 8.0个月)。2024 年 2 月,Wang 等人对 21 例患者卡多利单抗治疗前后配对肿瘤组织的基因表达谱进行了分析,旨在确定临床反应的生物标志物。结果表明,基线 CD74 基因表达与患者良好预后 (OS,HR=0.33,p=0.0463) 相关,基线时 CD74 基因表达高的肿瘤更有可能呈现免疫炎症微环境。此外,基线时 CD74 蛋白的高表达与更好的 PFS (HR=0.21,p=0.0065) 和 OS (HR=0.35,p=0.0615) 相关,凸显了其作为卡多利单抗治疗反应预测生物标志物的巨大潜力。
在针对 PD-L1 和 CTLA-4 的 bsAb KN046 的 I 期研究中,对 93 名晚期实体瘤患者进行了生物标志物探索性分析,评估了肿瘤 PD-L1 表达情况。结果表明,PD-L1 表达 <1% 和 ≥1% 的患者的 ORR 分别为 0% 和 13.6%(95% CI:6.4-24.3)。此外,与 PD-L1 表达阴性的患者相比,PD-L1 表达阳性的患者的中位 PFS 和 OS 延长(中位 PFS:2.5个月 vs 1.3个月;中位 OS:19.9 个月 vs 5.4个月)。该研究还发现 CD8 表达与 OS 改善之间存在相关性。在组合生物标志物中,PD-L1 阳性且 CD8 表达高的患者与其他患者相比具有更好的 OS(27.1个月 vs 9.2个月)。在 KN046 的 II 期试验中,PD-L1 TC <1%、1-49% 和 ≥50% 的患者中,BIRC 评估的 ORR 分别为 13.9%、17.6% 和 11.1%,而 BIRC 评估的中位 PFS 分别为 3.6个月、3.7个月和 5.1个月。
2024 年,Ding 等人对靶向 PD-1 和 CTLA-4 的 bsAb QL1706 进行了纵向血浆蛋白质组学分析。该研究分析了 22 名接受 QL1706 治疗的癌症患者的 113 个纵向血浆样本,其中包括 6 例肺癌。研究显示,疾病无进展 (DNP) 组的胆固醇代谢被激活,并确定了生物标志物 APOC3,与 DNP 组中高密度脂蛋白的部分重建密切相关。研究人员认为 PA、LDH 和 APOC3 可以作为预测 QL1706 疗效的潜在生物标志物。此外,基于蛋白质组临床特征的机器学习模型为 QL1706 队列提供了准确的预测。该模型的预测能力还可以扩展到抗 PD-1 治疗队列,从而为未来针对精准免疫治疗反应的临床试验奠定基础。
由于免疫系统的复杂性以及肿瘤的动态性和异质性,单一的生物标志物往往无法有效预测,因此需要进一步研究其他生物标志物和临床预后因素。我们期待未来对与 bsAbs 相关的生物标志物进行研究。
双ICI和bsAbs的组合策略
与化疗联合
无论是NSCLC还是SCLC,化疗都是主要的一线治疗方法之一。值得注意的是,在肿瘤治疗过程中,化疗药物对免疫系统具有双向作用,既能引起全身免疫抑制,又能清除特定免疫细胞,协助重建新的免疫系统。一方面,环磷酰胺、吉西他滨等药物和铂类化合物通过钙网蛋白暴露、自噬诱导、迁移率族蛋白1和ATP释放等机制增强肿瘤细胞的抗原性。另一方面,化疗可以通过增强肿瘤细胞对免疫系统的可见性来增加肿瘤细胞对免疫攻击的敏感性。此外,蒽环类药物和奥沙利铂等化疗药物与DNA复制和修复机制相互作用,引发免疫原性细胞死亡(ICD)和抗原特异性反应。化疗与免疫系统之间的相互作用为化疗与免疫疗法相结合的潜在增强疗效提供了理论支持。
在双ICI联合治疗背景下,大量临床试验探讨了双ICI与化疗联合治疗的临床疗效。Ⅱ期临床试验CheckMate 568分为两部分: 部分采用nivolumab和ipilimumab治疗患者,第二部分研究nivolumab和ipilimumab与化疗联合治疗。结果表明,虽然中位OS差异不大(第1部分:20.83个月,第2部分:19.35个月),但联合治疗后中位PFS显著延长(第1部分:5.19个月,第2部分:10.81个月)。Ⅲ期研究CheckMate 9LA进一步研究了nivolumab和ipilimumab与化疗联合治疗的临床疗效。患者被随机分为两组:一组接受联合治疗,另一组仅接受化疗。研究结果显示,与单纯化疗相比,联合治疗可延长生存期(中位 OS:14.13 个月 vs 10.74个月;中位 PFS:6.83个月 vs 4.96 个月)。durvalumab 和 tremelimumab 的 II 期临床试验(NCT03057106)也观察到了类似的结果,durvalumab 和 tremelimumab 联合化疗治疗组与双重 ICI 治疗组相比,中位 OS 和 PFS 均有所延长(中位 OS:16.6个月 vs 14.1个月;中位 PFS:7.72 个月 vs 3.22个月)。这些研究共同强调了双重 ICI 与化疗相结合的潜力,目前正在进行许多临床试验以进一步探索这种联合策略(NCT03158129、NCT03994393、NCT03975114、NCT03043872)。
目前,双特异性抗体和化疗联合治疗策略的研究尚处于早期探索阶段。靶向 PD-1 和 VEGF 的双特异性抗体 AK112 在其 II 期试验中表现出良好的抗肿瘤活性和安全性。该疗效扩展到无驱动突变的晚期 NSCLC 患者、EGFR 功能性突变且既往接受过 EGFR-TKI 治疗失败的患者以及既往接受过铂类系统性化疗和 PD-1/PD-L1 抑制剂治疗失败的患者的一线治疗。许多研究各种双特异性抗体的临床试验正在积极进行中,包括靶向 PD-1 和 CTLA-4 的卡多尼利单抗 (NCT04647344、NCT05377658)、QL1706 (NCT05487391) 和 MEDI5752 (NCT03530397)。总体而言,开发涉及免疫疗法和化疗的联合治疗策略的前景似乎一片光明。
与放射治疗联合
除化疗外,放射治疗是另一种常见的肺癌一线治疗方法,其原理是通过电离辐射直接杀伤肿瘤细胞。大量证据表明,放射治疗可以通过多种机制触发局部和全身免疫反应,从而对肿瘤免疫产生多方面的影响。例如,放射治疗可以诱导肿瘤细胞的ICD并释放损伤相关分子模式(DAMPs),进而促进树突状细胞(DC)的成熟。这些成熟的树突状细胞随后可以将肿瘤抗原呈递给CD8 + T细胞,启动特异性的免疫反应。此外,放射治疗可以表现出免疫抑制的特性。放射治疗与免疫系统之间的相互作用为这两种治疗方式的结合提供了理论基础。
“远隔效应”是指放射治疗引发的未受照射的远处肿瘤病灶的消退和排斥,这种现象已在包括肺腺癌在内的肿瘤中观察到。该现象的潜在机制可能涉及放射治疗增强肿瘤细胞的抗原呈递,从而增加CD8 + T 细胞的产生。这些新产生的 T 细胞通过血液运输到远处部位,从而影响照射区域以外的肿瘤。值得注意的是,一些研究表明免疫疗法可以增强远隔效应,而放射治疗可以增强免疫疗法的疗效。这种相互作用为免疫治疗的联合治疗策略提供了新的途径和机会。
一项随机 II 期研究研究了复发性 SCLC,评估了 durvalumab 和 tremelimumab 联合或不联合立体定向放射治疗 (SBRT) 的疗效。18 名患者被随机分配到 A 组,接受 durvalumab 和 tremelimumab 治疗,或 B 组,接受免疫增敏 SBRT 后进行 durvalumab 和 tremelimumab 治疗。结果表明,与 A 组相比,B 组的中位 OS 延长(A 组:2.8个月,B 组:5.7个月)。目前,许多探索双重 ICI 与放疗相结合的临床试验正在进行中,包括 nivolumab 和 ipilimumab 联合放疗(NCT04013542、NCT02696993)、durvalumab 和 tremelimumab 联合放疗(NCT02888743、NCT03923270)等。然而,研究 bsAbs 与放射疗法相结合的临床研究相对较少。
与靶向治疗相结合
肿瘤靶向治疗是通过干扰特定的分子靶点来抑制癌症的生长、进展和转移,包括抑制肿瘤细胞增殖、干预细胞周期、促进肿瘤细胞分化、抑制转移、诱导细胞凋亡、阻碍肿瘤血管生成等,是一种革命性的治疗方法。然而,目前靶向治疗面临着巨大的挑战,因为相当多的患者对治疗产生了耐药性。 近的研究表明,肿瘤靶向治疗可以触发肿瘤细胞的ICD,从而增强ICI的疗效。这一发现使得肿瘤靶向治疗与免疫治疗相结合成为可能,为克服耐药性和提高临床疗效提供了一种新方法。
I/II 期 MEDIOLA 研究评估了度伐单抗和奥拉帕尼联合治疗对携带种系 BRCA1 或 BRCA2 突变的转移性乳腺癌患者的疗效。结果显示,联合治疗 12 周后,80% 的患者病情控制良好,安全性良好。此外,III 期临床试验 IMspire150 研究 (NCT02908672) 评估了维莫非尼和考比替尼联合抗 PD-L1 单克隆抗体阿特珠单抗对携带 BRAF V600 突变的晚期或转移性黑色素瘤患者的临床疗效。研究结果表明,靶向治疗联合免疫治疗可显著延长 PFS(15.1个月 vs 10.6个月),证实了联合治疗方法的可行性和优势。目前,多项探索 bsAbs 与靶向疗法相结合的临床试验正在进行中(NCT05816499、NCT04646330、NCT05420220、NCT04777084)。
与其他治疗相结合
除上述联合治疗方法外,许多潜在的联合疗法都值得探索,为提高免疫治疗的临床疗效提供了更多可能性。使用表达抗原特异性嵌合抗原受体 (CAR) 的转基因 T 细胞进行过继免疫治疗是一种具有巨大前景的新兴癌症治疗方法。CAR 是将 T 细胞重定向到肿瘤表面抗原的合成受体,具有识别各种细胞靶标(包括蛋白质和非蛋白质实体)并激活 T 细胞的独特能力,而无需抗原加工和呈递,从而绕过人类 MHC 限制。虽然 CAR-T 细胞可以直接消除肿瘤细胞,但它们仍然易受免疫检查点的抑制。这使得将 CAR-T 细胞疗法与 ICI 相结合的策略成为焦点。多项使用小鼠肿瘤模型的临床前研究验证了CAR-T细胞疗法与ICI联合治疗的可行性,表明ICI可能是增强CAR-T细胞疗法临床益处的有效策略。该联合疗法的临床试验目前也在进行中(NCT04003649、NCT03726515)。
在小细胞肺癌中,DLL3 是 Notch 信号通路的抑制性配体,在小细胞肺癌肿瘤细胞表面高表达,与小细胞肺癌的进展相关。Rova-T 是一种靶向 DLL3 的人源化单克隆抗体,已证实在复发性小细胞肺癌中具有显著的抗肿瘤活性,且安全性可控。在免疫系统中,DLL3 在调节 T 细胞发育方面起着至关重要的作用。它的缺失会诱导 Notch 信号的活性,而 Notch 信号与 TCR 信号相结合,可促进 T 细胞分化。这表明,将 Rova-T 与免疫疗法相结合有可能增强对小细胞肺癌的临床益处。遗憾的是,一项关于 Rova-T 联合 nivolumab ± ipilimumab 治疗 2L + ES-SCLC 患者的 1/2 期临床试验 (NCT03026166) 表明,尽管 Rova-T 在 2L + ES-SCLC 中具有活性,但由于剂量限制性毒性 (DLT),与 nivolumab 和/或 ipilimumab 联合使用并不合适。
此外,各种新兴治疗方式,如 CAR-NK 细胞疗法和巨噬细胞靶向疗法,具有与免疫疗法相结合的潜力,为癌症治疗提供了更广泛的选择和可能性。
讨论和结论
抗体是由浆细胞产生的保护性蛋白,能够特异性地结合抗原。这种抗原结合的特异性促使抗体成为临床治疗中一个重要的研究领域,从而导致了 ICI 的出现,为癌症治疗提供了新的选择。在正常生理条件下,PD-1/PD-L1 和CTLA -4 等免疫检查点维持免疫系统的稳态,有效防止不受控制的自身免疫反应。然而,在癌症患者中,这些免疫检查点会削弱 TCR 信号传导,导致 T 细胞的效应功能下降,并促进肿瘤免疫逃逸。ICI 的出现为这一难题提供了一种潜在的解决方案,并且已证明对多种癌症类型有效,包括黑色素瘤、泌尿系统癌症、间皮瘤等。
目前肺癌的一线治疗主要包括铂类化疗。研究表明,ICI 单药治疗提供的生存益处有限,这促使联合治疗方法的出现,成为提高抗肿瘤疗效和生存结果的新方向 。双重 ICI 联合疗法中的 nivolumab 加 ipilimumab 和 durvalumab 加 tremelimumab 等组合有效提高了反应率,尽管可能会增加 TRAE 的风险。随着抗体工程技术的进步,bsAbs 的开发旨在提高治疗效果,同时降低毒性和 TRAE 的发生率。多种新型 bsAbs 正在研发中,准备进入临床试验,代表着肺癌治疗中一个有希望且不断发展的前沿。
作为双重阻断免疫疗法,双ICI联合疗法和bsAbs均同时具有两个靶点,从而加强了肿瘤免疫反应,达到了相加不止的效果,两种疗法的疗效均明显优于单药疗法。然而,双ICI联合疗法在提高缓解率的同时,也有可能增加TRAE的风险,而bsAbs的引入解决了这一难题,实现了疗效和安全性的平衡。此外,bsAbs的生物学效力和疗效可能高于双ICI联合疗法,这有待进一步研究。遗憾的是,与双ICI联合疗法中生物标志物的详细研究相比,BsAb治疗相关的生物标志物研究仍然有限,但正在迅速推进。
然而,双重免疫联合疗法和 bsAbs 都有其局限性。双重免疫联合疗法中固定的药物配对和 bsAbs 中固定的抗体价对其剂量、疗效和适应症施加了许多限制。此外,这些限制阻碍了新治疗策略的发展,例如与化疗和放疗的联合治疗。此外,双重免疫疗法可治疗的癌症范围相对有限。即使是同一种癌症类型,由于 PD-L1 和 TMB 等生物标志物的差异,患者之间的抗肿瘤疗效也可能存在显著差异。然而,这些生物标志物的类型和阈值仍需要系统探索,尤其是对于 bsAbs,研究相对稀缺。TRAE 风险的管理和耐药性的预防也对双重免疫疗法提出了重大挑战。由于不同药物的靶向抗原不同,抗肿瘤作用涉及激活多种信号通路,可能导致不可预见的免疫反应和耐药性。因此,各种免疫检查点、细胞因子和其他靶点之间的相互作用值得进一步研究,以提高这些疗法的有效性和安全性。
此外,化疗、放疗、靶向治疗等联合疗法的出现,为双免疫疗法和双特异性抗体的研发提供了新的可能性和方向。然而,这些疗法仍处于早期阶段,许多联合疗法尚未在临床试验中复制临床前研究的结果。irAE 和医疗成本的增加,以及治疗方案的选择,包括剂量、时间和顺序,仍然是研究人员长期探索的领域。
综上所述,尽管双重免疫疗法,包括双重ICI联合疗法和bsAbs,面临诸多挑战,但这些方法仍具有良好的发展前景。预计随着科技领域的不断进步,这些疗法将继续优化和发展,预示着癌症免疫治疗的新时代。


 医无忧服务热线:
医无忧服务热线:
