 400-028-6288
400-028-6288 在线客服
在线客服
 官方微信
官方微信
 400-028-6288
400-028-6288 在线客服
在线客服
 官方微信
官方微信

新闻动态
双特异性 T 细胞接合剂 (BiTE) 等新型 T 细胞免疫疗法正成为前列腺癌的有前途的治疗策略。BiTE 是经过设计的双特异性抗体,包含两个不同的结合域,可同时结合肿瘤相关抗原 (TAA) 以及免疫效应细胞,从而促进对癌细胞的免疫反应。前列腺癌富含肿瘤相关抗原,例如但不限于 PSMA、PSCA、hK2 和 STEAP1,在前列腺癌疾病领域使用 T 细胞重定向 BiTE 具有很强的生物学原理。临床研究中使用的早期 BiTE 构建体已显示出有意义的抗肿瘤活性,但与药物输送、免疫原性和治疗相关不良反应相关的挑战限制了它们的成功。新型 BiTE 构建体的持续开发将继续解决这些障碍,并在功效和安全性方面取得令人鼓舞的结果。本综述将重点介绍针对晚期前列腺癌患者的 BiTE 疗法的一些 新进展,以及正在进行临床评估的 BiTE 结构的不断发展的数据。
介绍
前列腺癌 (PCa) 是美国男性癌症死亡的第二大原因。预计 2023 年美国将有 288300 例新发 PCa 病例,导致 34700 人死亡。局限性前列腺癌通常可通过手术和/或放射疗法得到有效治疗。对于低风险或部分中等风险患者,可以考虑进行主动监测。尽管对于大多数患者来说,去势抵抗的产生是不可避免的现实,但雄激素消融疗法仍然是转移性疾病治疗的支柱。近年来,转移性去势抵抗性前列腺癌 (mCRPC) 的发病率有所增加,尽管治疗策略不断取得进展以改善生存率,但该疾病仍然无法治愈。雄激素受体信号抑制剂和紫杉烷等化疗药物已被证明有效,并能像镭-233放射疗法一样缓解疾病,但长期益处有限,且治疗相关毒性较大。 近,针对 PSMA 的放射性配体疗法(例如177Lu-PSMA-617)已显示出良好的效果,并凸显了针对选择性肿瘤相关抗原定制治疗的有效策略。
免疫检查点抑制剂等免疫疗法彻底改变了某些实体肿瘤和血液系统恶性肿瘤的治疗,但对 PCa 患者的疗效有限。近年来,T 细胞接合免疫疗法,包括嵌合抗原受体 (CAR) T 细胞疗法和双特异性 T 细胞接合 (BiTE) 疗法,已成为治疗各种血液系统恶性肿瘤的有希望的方式,并有望在 PCa 患者中证明疗效。在本综述中,我们重点介绍了正在为 PCa 患者开发的新型 BiTE 疗法,重点介绍了其疗效和耐受性的早期报告。我们旨在分享我们对 BiTE 成功和缺陷的看法,并反思 BiTE 疗法将如何塑造 mCRPC 治疗的未来。
T 细胞重定向作为免疫治疗策略
T 细胞接合疗法是一类免疫疗法,可增强患者自身免疫系统识别和靶向癌细胞的能力。目前, 获得 FDA 批准用于治疗晚期 PCa 的免疫疗法是 Sipuleucel-T,这是一种自体细胞免疫疗法,被认为通过抗原呈递细胞诱导刺激 T 细胞对前列腺酸性磷酸酶(一种在 PCa 中表达的抗原)的免疫反应起作用。到目前为止,Sipuleucel-T 的成功率有限,在当今新疗法时代,其整体临床益处尚未明确。尽管存在局限性,Sipuleucel-T 仍可作为 T 细胞重定向疗法可能有效且免疫疗法有可能对 PCa 产生变革性影响的原理证据。
更现代的 T 细胞重定向策略包括 CAR T 细胞疗法和 BiTE。CAR-T 需要改造患者的自体 T 细胞以表达嵌合抗原受体,从而使其能够识别并结合癌细胞表面的特定抗原。CAR T 细胞疗法在治疗某些血液系统恶性肿瘤方面已取得巨大成功,目前正在研究包括 PCa 在内的实体瘤,但由于诸多挑战(包括各种实体瘤的免疫微环境的复杂性),进展有限。前列腺癌中 CAR-T 的早期研究包括多项正在进行的 I 期研究,其中包括针对 PSCA 的 4-1BB 共刺激 CAR T 细胞疗法 (NCT05805371) 和多种针对 PSMA 的 CAR T 细胞疗法 (NCT03089203、NCT04249947)。
与 CAR-T 细胞疗法一样,BiTE 免疫疗法也将 T 细胞重定向至选择性 TAA,并已在血液系统恶性肿瘤中取得成功,从而为其在 PCa 等实体肿瘤中的研究打开了大门。双特异性抗体经过设计,含有两个不同的 scFv 结合域,能够同时识别和结合两种不同细胞类型上的不同抗原。在 PCa 中,双特异性抗体可以设计为靶向 PCa 细胞上表达的抗原以及各种 T 细胞受体,包括 CD3 和 CD28。BiTE 充当连接前列腺肿瘤和 T 细胞的桥梁,从而直接刺激细胞毒性 T 细胞活性,而不依赖于 T 细胞受体与主要组织相容性复合体共刺激之间的相互作用。随后的 T 细胞激活会触发专门针对表达靶抗原的细胞的细胞毒性免疫反应。
正在开发用于 PCa 的双特异性抗体有两种结构形式:(1) 基于单链可变片段的抗体,和 (2) 基于全长 IgG 的抗体。单链可变片段是通过多肽连接融合抗肿瘤和抗免疫细胞抗体的 IgG 重链和轻链的可变域而产生的,同时保留了它们的结合能力。IgG 样全长双特异性抗体是通过抗肿瘤和抗免疫细胞抗体的完整重链和轻链的异二聚化产生的,保留了与天然抗体相似的结构。
PCa 的特点是免疫学上“冷”的肿瘤微环境 (TME),这会阻碍免疫反应,导致免疫逃避和疾病进展。PCa 的 TME 的特点是肿瘤浸润淋巴细胞水平降低、抗原呈递细胞活性降低以及免疫抑制细胞类型(包括髓系抑制细胞)的存在增加。此外,PCa 表现出较低的肿瘤突变负担,从而限制了新抗原的免疫识别能力。由于这种免疫学上“冷”的 TME,免疫检查点抑制剂在其他实体肿瘤中表现出显著疗效,但在 PCa 中却产生了令人失望的结果。值得注意的例外是派姆单抗,这是一种抑制程序性死亡-1 (PD-1) 受体的 IgG4 κ 单克隆抗体,已获得 FDA 批准用于治疗具有高肿瘤突变负荷、高微卫星不稳定性或错配修复缺陷特征的 mCRPC 患者。通过同时结合免疫效应细胞和 TAA 来产生抗肿瘤反应,T 细胞重定向双特异性抗体经过 佳设计,可以克服 PCa 的“冷”TME,从而能够在 PCa 中成功使用免疫疗法。
前列腺肿瘤相关抗原作为 BiTes 的表位
TAA 是一种分子结构,通常是一种蛋白质,它被恶性细胞过度表达,可以被免疫系统识别为发起免疫反应的目标。免疫疗法在 PCa 治疗中的成功取决于识别和有效靶向 佳 TAA,以产生强大而特异的抗肿瘤反应。理想的 TAA 具有以下特点:它易于在肿瘤细胞表面接近,确保免疫效应细胞能够检测到它;它在特定肿瘤内的所有恶性细胞中普遍存在,从而降低免疫逃逸风险;它在患有相同癌症类型的患者中表现出保守性,从而能够开发出广泛适用的免疫疗法。此外,理想的 TAA 还具有肿瘤特异性,在肿瘤细胞而非非癌组织中表达,或至少主要表达于肿瘤细胞。开发针对 TAA 的高肿瘤特异性免疫疗法对于 大限度地减少肿瘤外激活、防止对健康细胞的损害以及确保药物的安全和耐受性至关重要。幸运的是,在 PCa 中已经发现了几种有前景的 TAA,包括 PSMA、PSCA、hK2 和 STEAP1 等。这使得 PCa 成为研究 BiTE 疗法的理想候选对象,并促进了许多具有独特结构、针对上述 TAA 的新型 BiTE 结构的开发。
前列腺特异性抗原 (PSA) 几乎只在前列腺上皮细胞中表达,并在大多数前列腺癌组织中检测到。虽然 PSA 被广泛用作诊断和监测前列腺癌的血清标志物,但它尚未成为可行的免疫治疗靶点。值得注意的是,前列腺特异性膜抗原 (PSMA) 是前列腺癌免疫治疗的一种有前途的 TAA。PSMA 是一种整合膜糖蛋白,在非肿瘤性前列腺细胞中检测到的量 少,但在大多数前列腺肿瘤中高度表达。虽然 PSMA 也存在于其他非恶性组织中,包括唾液腺、中枢神经系统、小肠、乳腺上皮和肾小管上皮,但其在非前列腺组织中的表达明显较低。PSMA 在肿瘤细胞中的显著过度表达以及有利于免疫细胞识别的细胞外定位使该 TAA 成为 佳靶点,并且已开发并实施了几种针对 PSMA 的 BiTE,用于早期临床试验。
前列腺干细胞抗原 (PSCA) 是一种糖基磷脂酰肌醇锚定细胞表面糖蛋白,在前列腺基底和分泌上皮细胞中表达。在 80% 以上的原发性恶性前列腺样本和骨转移中可检测到 PSCA 表达。与相应的非恶性前列腺组织相比,前列腺肿瘤中的 PSCA 表达增加,并且表达与更高的 Gleason 评分相关。与局限于前列腺的肿瘤相比,非器官局限性肿瘤和精囊侵袭中也观察到 PSCA 的上调。前列腺六跨膜上皮抗原 1 (STEAP 1) 是一种跨膜蛋白,主要在前列腺上皮中表达,但在结肠和肝脏中检测到的表达水平较低。STEAP 1 在 PCa 的不同阶段以及包括膀胱癌、结肠癌和卵巢癌在内的其他肿瘤中过度表达。人激肽释放酶 2 (hK2) 是一种丝氨酸蛋白酶,由 KLK2 基因编码,在恶性和非恶性前列腺组织中均有表达。然而,hK2 在 PCa 细胞中过度表达,其水平与疾病的严重程度相关,使其成为潜在免疫治疗干预的特定且可靠的靶点。
前列腺癌中的早期 BiTE
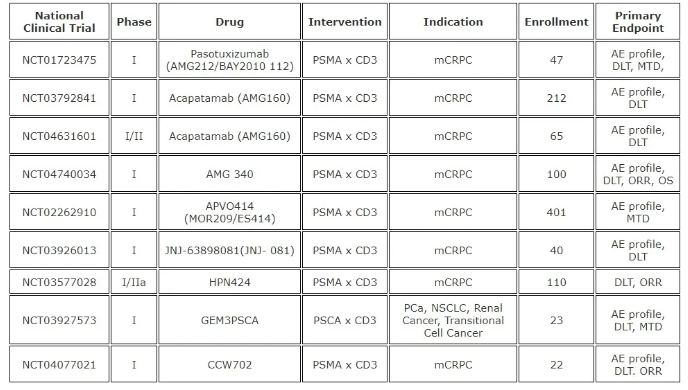
AMG 212(pasotuxizumab 帕索妥珠单抗)是一种抗 PSMA/CD3 BiTE,是早期用于 PCa 的 BiTE 免疫疗法之一。在一项临床前研究中,AMG212 能够有效结合 PSMA 表达细胞以及人类 T 细胞,从而触发 T 细胞活化、细胞因子释放和抗原依赖性靶细胞裂解。此外,AMG212 可有效延缓肿瘤生长,并导致人类 PCa 异种移植模型中的肿瘤缩小。一项 I 期试验 (NCT01723475) 招募了 47 名接受 AMG212 治疗的 mCRPC 患者,这些患者接受皮下 (SC) 或持续静脉 (cIV) 制剂治疗(SCn=31,IVn=16)。所有入组患者在接受 ≥1 种紫杉烷类药物治疗后均出现治疗失败。报告的 常见治疗中出现的不良事件 (TRAE) 是发烧、注射部位反应、发冷和疲劳。SC 队列中 87% (27/31) 的患者发生 ≥3 级 TRAE, 常见的是贫血 (39%) 和淋巴细胞计数减少 (26%)。cIV 队列中 81% (13/16) 的患者发生 ≥3 级 TRAE, 常见的是淋巴细胞计数减少 (44%) 和感染 (31%)。接受 ≥1 剂量 SC AMG212 治疗的 30 名患者中,所有 30 名均出现了抗药抗体 (ADA),平均发病时间为治疗后 22 天。ADA 持续存在,对糖皮质激素治疗等缓解措施没有反应。由于 ADA 发生率高,停止了对 SC 给药途径的进一步评估。在 cIV 队列中未检测到 ADA。经确定,SC 组中高滴度、持续的 ADA 反应是由于免疫原性给药途径,而不是 AMG212 氨基酸序列内的 T 细胞表位。在疗效方面,SC 队列中 佳总体 PSA 反应中位数为下降 25%,三分之一的患者 PSA 值 初下降 >50%,但 PSA 反应并不持久,并且通常会随着时间的推移升至高于基线水平,这可能是由于中和 ADA 的发展所致。在 cIV 队列中,血清 PSA 呈剂量依赖性下降,14 名患者在治疗期间出现 PSA 下降。在较高剂量(20、40 和 80 μg 队列)中,3/9 的患者出现 >50% 的下降。两名患者有长期反应,PSA 持续下降 >50% 50 周和 >80 周。AMG212 是 在临床研究中证明对 PCa 患者有效的 BiTE 单药疗法。 终,AMG212 因副作用发生率高且严重而停用,并且停止了对 AMG212 的进一步研究,转而支持新型 BiTE 结构。
AMG160(acapatamab 阿卡帕他单抗)是第二代抗 PSMA/CD3 BiTE,其特点是与抗体核心融合了额外的 Fc 片段,旨在延长药物半衰期,从而允许通过每两周一次的静脉输液进行更实用的给药。在一项针对对先前新型激素疗法和紫杉烷治疗有耐药性的 mCRPC 患者的 I 期研究 (NCT03792841) 中,32 名患者每两周接受一次 AMG 160 的短期静脉输注。细胞因子释放综合征 (CRS) 是 常见的不良反应(27 名患者),并伴有发烧、转氨酶升高和低血压。CRS 症状主要发生在第 1-2 个周期,并采用标准缓解方法进行管理。在 18 名有可测量疾病的患者中,RECIST(实体肿瘤疗效评估标准)反应包括 1 名确认的部分缓解、5 名病情稳定的患者和 5 名病情进展的患者。15/24 (63%) 的可评估患者出现 PSA 降低。在两个 高剂量水平组中,6/10 (60%) 的患者出现 PSA 降低 >50%。AMG160 的临床研究 终被暂停,取而代之的是 AMG340 和下一代抗 PSMA/CD3 BiTE,该研究具有低亲和力抗 CD3 臂,旨在减少免疫激活和 CRS。不幸的是,AMG340 近因不明原因停产,并且正在进行的 mCRPC 1 期剂量递增研究 (NCT04740034) 被无限期暂停。
APVO414 (MOR209/ES414) 是一种抗 PSMA/CD3 BiTE,采用 ADAPTIR 技术开发而成,包含两个单链可变片段同型二聚体,每个均能结合 CD3 和 PSMA。在临床前试验中,同型二聚体结构表现出更好的半衰期、稳定性和效力。在 I 期研究 (NCT02262910) 中,APVO414 表现出显著的免疫原性,大多数患者都出现了中和性 ADA。在剂量递增研究的初始队列中,7/12 (58%) 的患者出现了滴度非常高的 ADA(高达 1:250,00)。虽然没有患者因 ADA 而出现不良反应,但 ADA 滴度高的患者将药物清除至无法检测到的水平。将方案从每周静脉注射改为持续静脉输注,ADA 的发生率略有下降,从 58% 降至 50%,但滴度从 1:125000 大幅降至 1:160–1:320。 终,鉴于 APVO414 具有显著的免疫原性且缺乏足够的治疗效益,该研究被终止。
同样,使用创新 DuoBody 平台开发的抗 PSMA/CD3 BiTE JNJ-63898081 (JNJ-081) 也遇到了重大问题, 终导致试验提前结束。一项 I 期剂量递增研究 (NCT03926013) 评估了 JNJ-081 在 39 名经新型雄激素靶向治疗或既往化疗后病情进展的 mCRPC 患者中的作用。JNJ-081 初通过静脉注射给药,随后的一组患者采用皮下注射途径给药。 常见的 TRAE 是 CRS (65%)、疲劳 (49%) 和恶心 (43%)。在较高剂量下观察到 2 级 CRS,并通过皮下注射和递增剂量得到部分缓解。在每周静脉注射剂量 ≤1 µg/kg 的患者中,0/7 出现 2 级 CRS,在每周静脉注射剂量 3 µg/kg 的患者中,60% (3/5) 出现 2 级 CRS。75% (3/4) 接受每周 30 µg/kg 皮下注射且未进行预处理的患者出现 2 级 CRS,但接受较高剂量且进行预处理(即 5 和 20,然后 60 µg/kg)的患者中只有 25% (1/4) 出现 2 级 CRS。在治疗剂量大于 30 µg/kg 的 SC 组中观察到短暂的 PSA 下降。未观察到放射学反应。在免疫原性方面,在接受静脉注射治疗的 12 名患者中 2 名检测到 ADA 抗体,在接受 SC 治疗的 24 名患者中 14 名检测到 ADA 抗体,导致部分 SC 患者暴露不足。
HPN424 是同类首创的三特异性 T 细胞接合剂,具有传统的抗 PSMA/CD3 骨架,与第三个白蛋白结合 Fc 结构域融合,可增强药物稳定性并延长血清半衰期。一项 I/IIa 期研究 (NCT03577028) 评估了 HPN424 在 80 名接受过 2 次以上全身治疗的 mCRPC 患者中的疗效。 常见的 3 次以上 TEAE 是 AST 升高 (18%)、ALT 升高 (11%) 和贫血 (11%)。63% 的患者出现全级 CRS,未发生 4 级或 5 级 CRS。在相关研究中,在 56 名基线时可测量 CTC 的患者中,32 名 (57%) 出现循环肿瘤细胞减少。63 名患者中有 13 名 (21%) 的 PSA 较基线下降,包括 3 名 PSA50 和 2 名 PSA30 反应。由于疗效和毒性之间的不利平衡,停止了对该药物的进一步研究(表格1)。
当代 BiTE 临床研究
AMG509 或 Xaluritamig 是一种双特异性抗体,具有两个相同的人源化抗 STEAP1 结构域以及一个单链可变片段抗 CD3 链。AMG509 含有一个额外的 Fc 结构域以延长血清半衰期。靶向 TAA STEAP1 是一种六跨膜上皮抗原,在约 80% 的转移性前列腺癌中过度表达,并且与不良预后有独立关联。重要的是,STEAP1 在非肿瘤组织中的表达水平较低,使其成为 PCa 治疗的理想靶点。临床前研究表明,在各种异种移植肿瘤模型中,AMG509 诱导的 T 细胞介导的 STEAP1 表达癌细胞裂解。正在进行的 AMG509 I 期试验 (NCT04221542) 报告了 97 名 mCRPC 患者的数据,结果非常令人鼓舞。超过一半 (53%) 的患者在开始治疗时有放射学上可见的内脏转移,79% 的患者曾接受过 3 种或更多种疗法,其中 85% 的患者曾接受过以紫杉烷为基础的全身化疗。作为剂量递增的一部分,受试者接受的剂量范围为 0.001 至 2 mg,每周或每两周注射一次。根据 临床前研究中发现的 小有效剂量,目标剂量0.001 mg 到0.3 mg(n=45)或高剂量组,目标剂量为 1.0-2.0 mg(n=52)。 大耐受起始剂量为 0.1 mg,AMG 509 每周给药的 MTD 为 1.5 mg。
所有剂量水平均可见反应,药物剂量越高反应率越高。在接受至少一剂 Xaluritamig 的 97 名受试者中,49% 的患者达到 PSA50 反应。此外,24% 的受试者根据 RECIST 标准具有客观反应率 (ORR),在 97 名患者中 67 名可评估。在高剂量(0.75 mg或更高)组的 52 名患者中,这些反应改善为 59% 的 PSA50 反应率和 41% 的 ORR。在接受高剂量治疗的患者中,16 名(36%)达到 PSA90 反应,13 名(25%)继续治疗 6个月以上。 常见的不良反应是 CRS(72%),其次是疲劳(45%)、肌痛(34%)和发烧(32%)。大多数经历 CRS 的患者有 1 级或 2 级毒性,只有两例 3 级 CRS 事件,没有 4 级或 5 级 CRS。试验中的 26 名受试者(27%)接受了托珠单抗作为 CRS 治疗的一部分。18 名患者(19%)因毒性而停药,46 名患者(47%)需要中断和减少剂量。没有致命的不良反应。一名患者因被认为与治疗无关的硬膜下血肿继发性创伤而去世。此外,54% 的受试者产生了抗药抗体 (ADA),中位发病时间为 3个周期后。然而,ADA 阳性组达到 PSA50 的患者比例与 ADA 阴性组相当,因此 ADA 的发展与任何削弱药物活性的影响无关。ADA 形成不影响药物活性的原因是因为反应通常发生在 4 到 8 周内。
这些初步疗效结果远远超过先前在晚期 PCa 中发现的 T 细胞接合剂的结果,后者发现 PSA50 反应范围从 5%(JNJ-63898081 阶段试验)到半衰期延长的 AMG160 的 34%。鉴于 AMG509 的初始疗效数据显著改善,且不良反应或风险没有显著变化,这项正在进行的临床试验确立了 STEAP-1 是一种有前途的免疫治疗 TAA,而 AMG509 则是一种治疗 mCRPC 患者的有效药物。我们期待更多成熟的数据。
REGN5678 是同类首创的抗 PSMA/CD28 BiTE。I/II 期研究 (NCT03972657) 的初步结果检查了 REGN5678 与抗 PD-1 抗体 cemiplimab 的联合作用,这为使用 CD28 共刺激结构域作为双特异性抗体的一部分在实体瘤中具有临床活性提供了 证据。该研究招募了 35 名 mCRPC 患者,这些患者已接受过 ≥2 线全身治疗,每周接受 REGN5678 单药治疗 3 周,然后与 cemiplimab 联合治疗,直至出现进展或毒性。54% 的患者患有 ≥3 级 TRAE。CRS 仅限于 1 级严重程度,仅发生在 6 名患者中。有趣的是,4 名患者 (11%) 经历了 ≥3 级免疫介导不良事件,他们都受益于 PSA 下降,这表明可能存在相关性。不幸的是,有两名患者出现毒性反应并因此死亡:1 名患者死于急性肾损伤(不被认为与治疗有关),1 名患者死于噬血细胞性淋巴组织细胞增生症(被认为与治疗有关)。临床疗效与剂量增加有关。较低剂量下疗效极小,在 0.1 至 10 mg的治疗剂量下,只有 1/16 名患者出现 PSA 下降。在 30 mg时,1/4 的患者出现 PSA90 下降;在 100 mg时,3/8 的患者出现 PSA 下降(分别为 22%、44% 和 >99%);在 300 mg时,3/4 的患者出现 PSA 下降(分别为 82%、99% 和 >99%)。这项研究正在进行中,随机 II 期给药尚未确定。
CC1 是一种抗 PSMA/CD3 BiTE,具有独特的 IgG 支架 PSMA 抗体。CC1 抗体构建体具有增强的双重靶向能力,可促进免疫细胞更有效地渗透肿瘤,并可与不仅在肿瘤细胞上而且在肿瘤血管上表达的抗原结合。正在进行的 I 期试验 (NCT04104607) 招募了 14 名 mCRPC 患者,其初步结果令人鼓舞。 常见的毒性是 CRS,79% 的患者出现该毒性。CRS 未超过 2 级,大多数情况下无需使用托珠单抗即可缓解。所有患者的 PSA 水平均迅速大幅下降,与基线相比下降幅度高达 60%。剂量递增阶段的三名患者接受了 高剂量水平的多个治疗周期,并受益于升高的 PSA 的迅速大幅下降。总而言之,CC-1 具有良好的毒性特征和良好的临床活性。
这些令人鼓舞的结果促成了另一项 I 期试验 (NCT05646550) 的启动,该试验在经历 PCa 生化复发的患者中采用相同的 CC-1 BiTE。有趣的是,研究人员注意到 CC-1 治疗与血小板活化显著增加有关,同时伴有血小板总数下降,他们推测这是通过 TGFβ 依赖性过程发生的。在经历这种现象的患者中,T 细胞反应性和裂解靶细胞的能力显着降低。作者推测,同时阻断 TGFβ 轴以恢复血小板抑制可以显著增强 CC-1 BiTE 治疗的有效性。
LAVA-1207 是一种 BiTE,可结合 PSMA 和 Vγ9 Vδ2-T 细胞的 Vδ2 链,后者是强效的免疫效应细胞。虽然 BiTE 的开发主要集中在针对标准 CD3+ T 细胞,但这种新型结构利用未知节点类型:字体未知节点类型:字体δ-T 细胞作为替代靶效应细胞。未知节点类型:字体未知节点类型:字体-T 细胞诱导快速的先天性免疫反应,而传统的效应 T 细胞则具有形成记忆细胞的能力。未知节点类型:字体未知节点类型:字体T 细胞扩增与更长的生存期相关。正在进行的 I/II 期临床试验 (NCT05369000) 采用 LAVA-1207,通过每两周输注给药,正在治疗 16 名患有难治性转移性去势抵抗性疾病的患者。该试验已经成功确定了 40 µg 的 大耐受剂量。总体而言,LAVA-1207 表现出良好的安全性,与治疗相关的不良事件严重程度为轻度至中度,与剂量无关,并且不会导致治疗中断。 常见的毒性是疲劳、恶心、转氨酶升高和输注反应。8 周评估点的初步数据显示,在评估的八名患者中,三名表现出病情稳定。还需要进一步的临床活动数据,但 LAVA-1207 的顶线结果令人鼓舞。
HER2 BAT 是抗 CD3 × 抗 Her2 双臂活化 T 细胞,以非 MHC 限制的方式靶向 HER2 肿瘤抗原。在一项临床前研究中,HER2 BAT 相关活化 T 细胞在肿瘤接触后表现出抗肿瘤细胞毒性、有效的肿瘤内运输和分泌细胞因子(如 IFNγ、TNFα 和 GM-CSF)。此外,HER2 BAT 在 HER2 低表达前列腺细胞系中表现出肿瘤靶向性。在 I 期研究 (NCT03406858) 中,可评估患者未出现剂量限制性毒性。一名患者表现出部分反应,三名患者的 PSA 水平显着下降。这些数据为进一步研究该药物以及随后的 II 期研究提供了强有力的依据,该研究评估了 HER2 BAT 与 PD-1 抑制剂派姆单抗联合用于先前接受雄激素受体轴靶向药物和多西他赛化疗治疗的 mCRPC 患者。13 名可评估患者中有 6 名 PSA 下降 25% 或更多,14 名患者中有 5 名在 6 个月时无进展。该方案耐受性良好,毒性包括发烧、发冷、头痛、恶心和肌痛。
BiTE 疗法对 PCa 的研究不仅限于前列腺腺癌,还包括前列腺神经内分泌肿瘤 (NEPC)。AMG 757 (Tarlatamab) 是一种抗 delta 样配体 3 (DLL3)/CD3 BiTE,目前正在进行 Ib 期临床试验 (NCT04702737)。DLL3 在前列腺 NEPC 中高度表达,尤其是那些在治疗过程中从腺癌转变为高级别 NEPC 的 NEPC。AMG 757 在正在进行的小细胞肺癌 1 期临床试验 (NCT03319940) 中已证明其安全性和有效性人们对其在治疗选择有限的 NEPC 中的潜在作用持乐观态度。
CB307 是一种新型三特异性抗体治疗剂,靶向 CD137 (4-1BB)、PSMA 和人血清白蛋白,仅在 PSMA 阳性细胞存在的情况下选择性增强免疫细胞活性。CD137 激动剂刺激免疫细胞增殖、细胞因子产生和存活。在临床前模型中,CB307 增强了 PSMA 表达细胞中的肿瘤细胞杀伤力,并且在与 PD-1/PD-L1 抑制剂联合使用时观察到增强的肿瘤细胞细胞毒性。一项 I 期研究 (NCT04839991) 目前正在研究 CB307 作为单一疗法和与派姆单抗联合治疗晚期和/或转移性 PSMA 阳性肿瘤(包括 mCRPC)患者的安全性和有效性。
REGN4336 是一种 PSMAxCD3 双特异性抗体。在临床前模型中,REGN4336 表现出强大的 PSMA 依赖性抗肿瘤活性,且具有剂量依赖性。临床前数据表明,在去势抵抗性前列腺模型中,REGN4336 与 cemiplimab 联合使用具有协同作用。正在进行的 I/II 期研究 (NCT05125016) 正在评估 REGN 4336 作为单一疗法或与 cemiplimab 联合使用,以评估安全性、耐受性和药代动力学,以及评估转移性去势抵抗性前列腺癌患者的初步抗肿瘤活性。
BiTE视角:成功与挑战
BiTE 免疫疗法是一种新兴的治疗方式,具有良好的治疗潜力。尽管 T 细胞介导疗法具有潜力,但药物配方仍处于早期开发阶段,迄今为止报告的早期试验表明,在安全性和有效性方面存在一些缺陷和成功之处。影响 BiTE 疗法应用的一个主要障碍是与免疫激活效应相关的不良安全性,即 CRS、免疫效应细胞相关神经毒性综合征 (ICANS) 和靶向/非肿瘤 (OTOT) 毒性。
CRS 是由于 T 细胞激活过程中分泌的促炎细胞因子释放过多而导致全身炎症反应失控所致。使用地塞米松进行预防性治疗和逐步增加剂量已被证实可降低 CRS 的发病率。同样,ICANS 毒性与过度免疫激活有关,但病理生理学尚不明确,据推测继发于局部中枢神经系统炎症。ICANS 的临床表现多种多样,包括头痛、精神状态改变和脑病。 后,当非癌组织中的 TAA 靶标识别导致意外交叉反应和细胞裂解时,就会发生 OTOT。可以通过选择对肿瘤组织具有高表达和特异性且在非肿瘤组织中生理表达水平较低的 TAA 靶标来避免 OTOT 的预防。这些治疗相关的毒性导致多项临床试验提前终止;然而,新一代 BiTE 结构已显示出更好的安全耐受性和有效的治疗剂量。
作为一种疗法,BiTE 疗法具有克服免疫逃避的潜力,这是 PCa 治疗中观察到的一个重大障碍。肿瘤已证明能够通过多种免疫逃避机制来避免免疫介导的消除,包括抗原性丧失、免疫原性丧失和免疫抑制肿瘤微环境的产生。晚期 PCa 细胞下调 MHC I 类分子,导致抗原性丧失并避免原生免疫检测。此外,PCa 细胞会分泌免疫抑制细胞因子并募集调节性 T 细胞,从而形成免疫学上“冷”的 TME。BiTE 疗法为克服这些免疫逃避机制带来了希望,早期试验已有效地将 PCa TME 转化为富含免疫原性因子的“热”环境。尽管早期临床试验中的治疗反应各不相同,但新一代 BiTE 疗法已显示出更好的治疗效果。然而,与其他类型的免疫疗法类似,BiTE 疗法容易通过 TAA 靶标下调而产生治疗耐药性,从而导致长期疗效下降。因此,与其他免疫疗法治疗模式(如 CAR-T 和免疫检查点抑制剂)的多模式联合治疗可能会表现出协同作用,并提高反应的持久性。
由于初始制剂的半衰期较短,需要持续静脉注射,BiTE 疗法 初面临多项后勤挑战。尝试皮下给药会导致 ADA 快速形成。幸运的是,新的 BiTE 结构已采用半衰期延长 (HLE) 制剂进行设计,这显著增加了半衰期并允许间歇性给药。HLE 制剂具有“现成”药物制造的潜力,这将使 BiTE 疗法能够广泛分布,生产成本更低,并且与 CAR-T 不同,无需个性化药物制造。
免疫肿瘤学的发展和 BiTE 疗法的初步疗效促使人们创造了各种新药物配方,包括 CAR-T、同时多重相互作用 T 细胞接合剂 (SMITE)、双亲和力重定向双特异性抗体 (DART)、CAR-NK、双特异性杀伤接合剂 (BiKE) 和三特异性杀伤接合剂 (TriKE)。与 BiTE 疗法类似,CAR-T 代表了另一种 T 细胞重定向疗法,在血液系统恶性肿瘤中表现出强大的抗肿瘤活性,并在早期临床试验中显示出在治疗实体肿瘤恶性肿瘤方面有希望的潜力。CAR-T 疗法的障碍包括为个别患者量身定制的药物、在免疫功能低下的宿主中给药前进行淋巴细胞清除以及与 BiTE 疗法类似的不良安全影响。CAR-NK 疗法是 CAR-T 疗法的延伸,它利用免疫系统的自然杀伤 (NK) 细胞代替 T 细胞进行激活。这种疗法表明,NK 细胞保留了识别 TAA 下调的靶肿瘤细胞的先天能力,这是肿瘤细胞免疫逃避策略的一部分。此外,NK 细胞寿命的缩短已被证明可以提高这些药物的安全性,有利的临床前研究为未来的临床试验带来了令人兴奋的潜力。SMITE 和 DART 疗法利用 BiTE 疗法的工程框架同时针对多个 TAA,目的是防止获得性肿瘤耐药性,这在用于治疗血液系统恶性肿瘤的 BiTE 疗法中已被观察到发生。相比之下,BiKE 和 TriKE 疗法的设计与 BiTE 类似,但增加了抗 CD16 结构域,以取代抗 CD3 结构域,从而以 NK 细胞活化而不是 T 细胞为目标,希望通过 NK 细胞免疫防御提高疗效。 后,新型癌症疫苗研发正在积极进行中,利用新发现的 TAA,目标是针对体液免疫和适应性免疫。虽然还需要进一步研究来验证这些新开发的疗法的疗效,但免疫疗法中的新治疗方式将极大地改变 PCa 的治疗模式。
结论
免疫疗法的兴起在过去十年中彻底改变了多种癌症的治疗方法。目前,越来越多的文献支持 T 细胞重定向双特异性抗体的出现,该抗体靶向 PCa 肿瘤相关抗原,是一种有前途的治疗方式。早期临床试验研究了 mCRPC 患者的 BiTE 疗法,数据一致表明其具有抗肿瘤活性。随着正在进行的针对新型 TAA(如 STEAP-1)的下一代 BiTE 构建体的临床试验报告了有希望的初步结果,安全性和疗效均有所改善,人们的乐观情绪正在增长。BiTE 疗法未来的成功取决于持续开发能够克服免疫抑制肿瘤微环境的 BiTE 构建体、有效靶向具有有限 OTOT 的新型 TAA,以及制定减轻免疫相关毒性(即 CRS)的策略。我们热切期待多项正在进行的临床研究的 终结果,但 终仍需要进行更多研究来确定 PCa 疾病连续体中治疗 有效的 佳空间,以及研究可能显示治疗协同作用和改善持久性的联合疗法。
下一篇:曲格列汀长效降糖新选择


 医无忧服务热线:
医无忧服务热线:
