 400-028-6288
400-028-6288 在线客服
在线客服
 官方微信
官方微信
 400-028-6288
400-028-6288 在线客服
在线客服
 官方微信
官方微信

新闻动态
在从罕见病进军常见代谢病后,血液病领域也有望于近两年迎来小核酸疗法上市。
5月7日,中国国家药监局药品审评中心(CDE)官网公示,赛诺菲(Sanofi)、Genzyme公司联合申报的1类新药fitusiran注射液上市申请获得受理。该产品是赛诺菲管线中 款申报上市的RNAi疗法,也是血友病领域首款RNAi疗法。
2018年,赛诺菲以116亿美元收购刚上市1年的Bioverativ,从此高调入局罕见血液病领域并占据重要地位。随着fitusiran申报上市,RNAi疗法有望为赛诺菲在血液病管线再下一城。
我国血液病领域小核酸药物研发也不断传来好消息。5月29日,瑞博生物宣布其抗血栓siRNA药物RBD4059获得欧洲药品管理局(EMA)II期临床试验许可。
血液疾病是一类涵盖范围广泛的疾病,该类疾病具有不同的起源、症状和治疗方法。例如,影响凝血功能和血小板的血液疾病可导致血友病、血栓和贫血。管理血液和出血性疾病给患者带来了巨大的负担,因为该类疾病通常需要终身治疗来控制病情并预防严重的并发症。
在血液病治疗领域,小核酸疗法展现出了其革命性的潜力。通过设计特异性的寡核苷酸分子(如RNAi/ASO/适配体)靶向影响血液病的关键基因,不仅可以在分子层面上调节血液病发病机制,还能避免传统治疗频繁注射的不便。更重要的是,小核酸疗法的高度特异性和可调节性为个体化治疗提供了可能,有望实现更精准、更有效的血液病治疗方案。
根据insight数据库,目前血液病领域有38款药物在研,进展 快的包括正在申请上市的赛诺菲/Alnylam开发的血友病siRNA药物fitusiran;一款正在进行临床3期,为再生元/Alnylam针对PNH的Cemdisiran。绝大部分(24款)处于临床前研究阶段。
值得期待的是,我国小核酸企业瑞博生物、圣诺医药、舶望制药、中美瑞康、圣因生物等也对血友病领域进行了布局。其中瑞博生物的RBD4059是全球靶向FXI的抗血栓siRNA药物。
本文将对进展较快的三大领域:抗凝、血友病、溶血性疾病的小核酸药物开发现状进行梳理,仅供参考。
01
目前的抗血栓药物治疗包括抗凝剂,如华法林、FXa抑制剂和凝血酶抑制剂等,其中 常用的是FXa小分子抑制剂阿哌沙班及利伐沙班,2022年销售额分别为118亿美元和73亿美元,市场规模巨大。
虽然这些传统抗凝药可有效降低血栓形成的风险,但它们可能使患者面临显著的出血风险,因为它们针对的是正常凝血所需的因素。高达40%的符合条件的患者未接受直接口服抗凝血剂治疗或治疗不充分,因为患者认为出血的风险超过了预防血栓形成的需要。
针对抗凝治疗不充分的现状,有近十种抗凝小核酸正活跃于不同的临床试验阶段,药物类型涉及ASO、siRNA、适配体等,靶点包括凝血因子11、凝血因子12、vwf等。其中进展 快的是Ionis开发的靶向FXI的ASO药物fesomersen,于2020年进入临床2期;瑞博生物开发的靶向FXI的RBD4059(SR-059)于近日进入临床2期,是全球靶向FXI的抗血栓siRNA药物。
值得一提的是,我国小核酸企业进展领先,包括瑞博生物、圣诺医药、靖因药业已经将抗凝小核酸推向临床。
其中,FXI抑制剂凭借较低的出血风险,近年来在抗血栓领域备受关注。
FXI是FXIa的酶原形式。FXIa是一种人类凝血丝氨酸蛋白酶,主要在肝脏中生物合成,少量在胰腺和肾小管中合成。除了因子IX,FXIa还可以激活因子V、VIII、X和XII,并抑制重要的凝血调节因子。与其它凝血因子不同,FXI缺乏的人很少发生自发性出血,许多人即使接受手术也不会明显出血。研究表明,严重的FXI缺乏甚至可降低缺血性中风和深静脉血栓的风险。FXIa在血栓形成中的作用可能大于在止血中的作用,现有的临床数据已支持这一观点,即抑制FXIa可能提供抗血栓效果而不存在出血风险。
FXI在止血和血栓形成中的不同作用(左图-止血;右图-血栓形成)
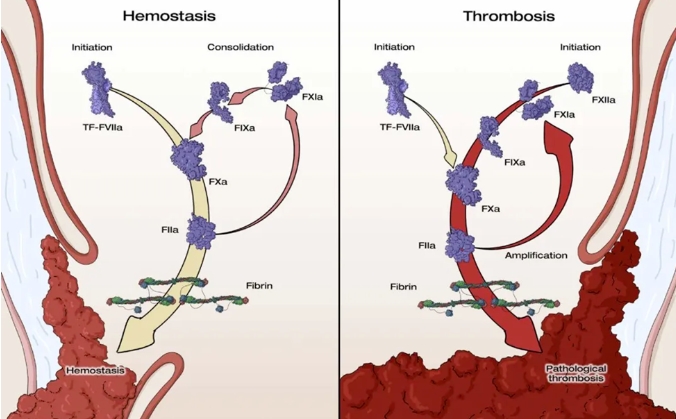
FXI抑制剂包括可以降低FXI水平的药物,以及阻断FXIa作用的药物。通过一种或两种机制抑制FXI,有望将止血与血栓形成进程解耦联,因此这是一种有潜力且方便的抗凝选择,特别是对于血栓形成和出血风险高的患者,或者在直接口服抗凝药抑制因子Xa和IIa的证据不足的情况下。
Ⅺ因子抑制剂的研发历时漫长,目前研发中的Ⅺ因子抑制剂可分为反义寡核苷酸(ASO)、siRNA、单克隆抗体(mAb)、小分子、天然抑制剂以及核酸适配体等多种形式,可口服、可肌注,其中,ASO与mAb不经过肾脏排除,为透析患者或严重肾功能不全患者提供了新的选择;而siRNA有望凭借长效性优势获得一席之地。
药物名称:fesomersen靶点:FXI企业:Ionis
进展:II期临床
Fesomersen(IONIS-FXI-LRx)是Ionis 利用配体偶联反义药物技术(ligand-conjugated antisense, LICA)开发的一款反义寡核苷酸药物,旨在减少凝血因子 XI 的产生。Fesomersen是具有三个触头形式和n-乙酰半乳糖安偶联的第二代ASO,是对前身IONIS-FXIRx (bay2306001)的递送升级,通过与肝脏中的去唾液酸糖蛋白受体结合发挥作用,皮下给药每月一次或更少。
在 2022 年美国肾脏病学(ASN)年会上,公司展示了反义寡核苷酸疗法 fesomersen 用于治疗终末期肾病(ESRD)血液透析患者的 IIb 期 RE-THINC ESRD 研究的积极结果:
· fesomersen 在其 IIb 期临床研究中达到了主要终点。该研究中,307 名终末期肾病血液透析患者经历了为期 24 周的治疗,患者的大出血事件发生率没有增加。
· 经过每 4 周一次不同剂量的药物治疗,受试患者的稳态 FXI 水平实现了剂量依赖性和持续性降低,透析回路凝血和 AV 通路血栓形成的发生率随之显著下降。
· 总的来说,fesomersen 在该研究中显示出良好的安全性和耐受性。
然而虽然获得了积极结果,却遭合作方拜耳退货。2015 年,Ionis 与拜耳达成合作共同开发该药物,后者预付了 1 亿美元。在此之后,拜耳斥资 5500 万美元将药物推进至 II 期研究,又经过两次交易后,拜耳已经累计支付了 1.85 亿美元。然而在2022年11 月 4 日,Ionis 宣布拜耳将把 fesomersen 的使用权归还给公司。
药物名称:RBD4059(SR-059)
靶点:FXI
企业:瑞博生物
进展:II期临床RBD4059是全球靶向FXI的抗血栓siRNA药物,是一款由瑞博生物基于其肝靶向技术平台开发的GalNac偶联siRNA药物,通过抑制凝血因子XI(FXI)和阻断内源性凝血途径的激活,从而实现其抗凝血/抗血栓的作用。
在1期临床试验中,RBD4059显示出了良好的安全性和有效性。根据瑞博生物此前在2023年欧洲心脏病学会(ESC)会议上公布的数据,临床前研究数据显示该产品对FXI表达和活性具有高效和持续抑制作用,预计在临床上具有长期持久的疗效,提高患者依从性。
2024年5月29日,瑞博生物宣布RBD4059于近日获得欧洲药品管理局(EMA)II期临床试验许可。该试验是一项随机、双盲、安慰剂对照的II期临床研究,旨在评估RBD4059在稳定的冠状动脉疾病患者中的安全性、有效性和药代动力学。该项试验同时获准在瑞博生物欧洲研发中心自有的符合欧美监管标准的II期临床中心开展。
药物名称:STP122G
靶点:FXI
企业:Sirnaomics
进展:I期临床
STP122G为Sirnaomics领先的GalAhead™十一因子RNAi疗法项目候选药物。作为集团十一因子治疗项目的一部分,STP122G已于2023年3月向美国食品药物管理局提交了IND申请,并于4月启动了其I期临床试验。该项目适用于广泛的疾病适应症,如预防心房颤动、治疗心房颤动导致的中风及免疫治疗后的癌症患者、以及改善全膝关节置换恢复。STP122G为采用Sirnaomics专有的GalNAc RNAi递送平台GalAhead™的候选药物。
2023年12月5日, Sirnaomics宣布STP122G用于抗凝治疗的I期临床试验“首次人体研究” 序列完成。 序列组共有8名受试者,其完成了给药并接受了140天的随访。安全数据显示没有出现剂量限制性毒性或严重不良事件,故此本次临床研究将推进第二序列剂量组。Sirnaomics预计 多为本次临床试验招募5个剂量递增序列组。
药物名称:SRSD107
靶点:FXI
企业:靖因药业
进展:I期临床
SRSD107注射液是靖因药业自研的双链siRNA药物。通过特异性肝靶向凝血因子XI(FXI)mRNA,抑制FXI的蛋白表达,阻断内源性凝血途径的激活,从而达到抗凝血/抗血栓的作用。临床前试验数据显示,单次皮下注射可实现几乎100%敲低FXI表达的效果,且持续时间达半年之久,同时未见出血。兼具强效、持久的有效性和良好的安全性,有望成为潜在“First-in-Class”和“Best-in-Class”的新一代更安全的抗凝药物,实现半年或更长的给药频次且降低出血风险,成为常见疾病的差异化治疗方式。
2024年4月1日,靖因药业宣布其自主研发的新型抗凝小核酸药物SRSD107注射液国内Ⅰ期临床试验顺利完成首例受试者给药。这也是在国内进入临床的首款siRNA抗凝药物。SRSD107正在进行一项随机、双盲、安慰剂对照的单剂量递增的临床研究,旨在评估其的安全性、耐受性、药代动力学和药效学特征。靖因药业的眼光也不止局限于国内,澳大利亚也在同步开展一期临床,已完成前两个剂量组受试者的入组给药,目前进展顺利。
02
针对凝血功能障碍,除了抑制凝血作用抗血栓,小核酸还可以通过靶向凝血酶或因子Ⅷ与vWF,降低血友病患者的出血事件来发挥作用。
血友病是一种终身的、遗传性的出血性疾病,主要影响男性。A型和B型血友病患者会自发地在关节或肌肉中出血,受伤后可能需要更长的时间来止血。
对于血友病,预防治疗比按需治疗更能有效防止残疾。血友病的基础治疗是按需止血治疗,指的是明显出血时给予凝血因子的替代治疗,目的在于及时止血。但是,按需治疗只是出血后治疗,无法阻止重型血友病患者反复出血导致关节残疾的发生。相反,血友病预防治疗是指为了防止出血而定期给予的规律性凝血因子替代治疗,是以维持正常关节和肌肉功能为目标的治疗。预防治疗是血友病患者减少出血、减少残疾、提高生活质量,甚至像正常人一样生活的关键。因此,预防治疗一直被国内外血友病专家及诊疗指南推荐。
为了应对替代疗法以及传统治疗药物造成的风险,近年来一系列创新药物及疗法具有更优疗效及安全性,有望改善现有治疗模式。其中,小核酸药物有望凭借更长的作用时间和有效性脱颖而出。
据不完全统计,全球共有十款针对血友病的小核酸药物在研,其中进展 快的fitusiran靶向抗凝血酶,已在中国递交了上市申请;此外,Archemix的靶向vwf的适配体疗法进入了临床2期(但insight数据库显示状态不活跃)。我国布局血友病小核酸疗法的企业,瑞博生物同样采用靶向vwf的适配体疗法,中美瑞康的RAG-20采用小激活RNA(saRNA)的药物形式开发。
药物名称:Fitusiran
靶点:抗凝血酶
企业:赛诺菲和Alnylam
进展:I期临床
Fitusiran由赛诺菲和Alnylam公司联合开发,这是一款靶向抗凝血酶开发的小干扰RNA疗法,针对A型和B型血友病。通过与表达抗凝血酶的RNA相结合,降低抗凝血酶的产生,从而恢复凝血因子和抗凝血因子之间的平衡,达到降低血友病患者出血事件的作用。这款创新疗法只需每个月皮下注射一次,与常规预防性凝血因子注射相比,为患者控制出血风险提供了很多便利。
临床 1 期表明,在没有抑制剂的情况下,fitusiran可以降低 A 型和 B型血友病患者的抗凝血酶 (AT) 水平并增加凝血酶 (凝血酶)的产生;临床2 期研究进一步表明,在替代因子或旁路药物的共同给药期间,fitusiran 的安全性和耐受性数据同样令人鼓舞,并且没有发生血栓栓塞事件。
在已完成的三项fitusiran针对成年人和≥12岁的青少年的临床三期试验中,ALNAT3SC-003入组患者为自体产生抑制物所以需要旁路制剂(bypassing agent BPA)管理出血的患者;ALN-AT3SC-004为不产生抑制物,由浓缩凝血因子管理出血的患者;ALN-AT3SC-009针对的是所有患者,包括产生或不产生抑制物的全部患者。各组的治疗剂量皆为80mg每月。
研究显示:fitusiran皆表现出良好的活性,并展示了具有统计学意义的针对出血减少疗效;其中在ALN-AT3SC-003试验中,与需要旁路制剂的患者相比,使用fitusiran的患者年出血率下降约89.2%;在ALN-AT3SC-004试验中,与需要浓缩凝血因子的患者比较,使用fitusiran的患者年出血率下降约89.9%。两组实验结果皆显示,使用fitusiran的亚组中位年出血率为0。
在ALN-AT3SC-003、ALN-AT3SC-004和ALNAT3SC-009三个实验中,药物发挥疗效阶段没有出现过出血事件的患者占全部使用fitusiran治疗的患者的百分比,分别为65.8%、50.6%和63.1%。
2024年5月7日,国家药监局药品审评中心(CDE)官网发布信息显示,赛诺菲申报的fitusiran注射液上市申请获受理。该药物可以治疗血友病A和B患者,不管他们体内是否表达抑制外源凝血因子的抑制物。
药物名称:ARC1779(Egaptivon Pegol)
靶点:vWF
企业:Archemix
进展:临床2期
ARC1779适配体是ARC1172的聚乙二醇化形式,聚乙二醇化可防止核酸酶降解,同时稳定对血管性血友病因子(VWF)A1结构域的亲和力。聚乙二醇化还通过阻断VWF A1结构域与血小板GPIb受体的结合,减少血小板粘附、聚集和血栓形成,抑制VWF的血栓前功能。
ARC1779用于治疗血栓性血小板减少性紫癜(TTP)和血管性血友病2B型患者的VWF相关血小板功能紊乱。一项临床试验评估了ARC1779在VWF相关血小板功能紊乱患者中的安全性、药代动力学和药效学,结果表明ARC1779可以抑制血小板聚集,而不会显著增加出血。一项II期临床试验研究了ARC1779对颈动脉内膜切除术后即刻患者脑微栓塞的影响,然而因招募患者不足,该研究不得不暂停。尽管如此,对纳入的急性TTP患者进行的重要观察证实,当与血浆置换疗法结合使用时,阻断VWF的A1结构域有可能增加血小板计数。
药物名称:RBD2018
靶点:vWF
企业:瑞博生物
进展:临床前(国外已完成临床试验I期和IIa)
RBD2018是一种靶向血管性血友病因子(vWF)的核酸适配体,拟开发的适应症为血友病A。药物分子与vWF特异性结合,阻止vWF和其携载的FVIII的清除,延长FVIII的半衰期,同时提高FVIII活性。本品国外合作方已经完成临床试验I期和IIa,结果显示良好安全性和有效性。瑞博拥有产品大中华区开发、生产和商业化权益,计划启动针对血友病A的临床试验。
03
溶血性疾病:靶向C5的Cemdisiran已经进入临床3期
补体系统在病原体免疫监测和组织内稳态中起着关键作用。然而,破坏其严格的调控机制,会助长炎症损伤的恶性循环,使病情恶化。针对补体系统介导的临床疾病,如阵发性睡眠性血红蛋白尿症、lgA肾病、重症肌无力等,小核酸企业纷纷建立了靶向补体系统药物开发
阵发性睡眠性血红蛋白尿(PNH)是一种以慢性血管内溶血与骨髓衰竭为主要表现的罕见病,其发病率约为百万分之1.3,患病率约为百万分之15.9。除了骨髓移植,阵发性睡眠性血红蛋白尿症(PNH)尚无其他有效治愈手段,控制溶血发作是临床上治疗该病的主要手段。
IgA肾病是目前世界范围内 常见的原发肾小球疾病,但其治疗尚无特效方案, 主要是充分支持治疗,包括血压控制、饮食控制、肾素-血管紧张素受体阻滞剂(RASi)等治疗,部分患者需使用激素和免疫抑制剂的治疗。
重症肌无力是一种高发病率的罕见病,其中约10-15%的患者是难治性MG。80-90%的患者为乙酰胆碱受体(AChR)抗体阳性。AChR抗体阳性MG病理的主要驱动因素是补体激活,补体级联反应的作用已在患者和MG动物模型中得到很大程度的证实。重症肌无力目前治疗主要采用非生物药物,为超适应症使用的免疫抑制剂或类固醇,主要为甲泼尼龙、环磷酰胺。
针对现有治疗存在的问题,许多新药正处于研发之中。根据在补体系统中的作用位点的不同,这些新药可以分为以下几类: (1) C5抑制剂;(2) C3抑制剂;(3)旁路途径的抑制剂等。
(1)抑制补体C5是具有显著临床症状的PNH患者的治疗标准。补体蛋白C5处于补体级联反应的末端,因此靶向这一蛋白可以调控所有3种不同通路激活的补体信号。在多种补体介导的免疫疾病中,补体介导的免疫反应攻击患者自身的健康组织和细胞,导致不同组织和器官的损伤。抑制C5补体的活性可以抑制这种对自身的免疫攻击,从而缓解疾病症状。(2)C3作为补体途径中更上游的分子,阻断其作用会引起更彻底的补体系统抑制,不仅可以阻断C5介导的血管内溶血,同时也不会像C5抑制剂那样发生血管外溶血。然而,这种更为彻底的阻断的安全性一直备受质疑。(3)旁路途径抑制剂从机制上来说对血管外溶血和血管内溶血均有效果,同对补体激活的阻断相比C5抑制剂更有选择性,因此在潜在的感染风险方面具有更高的安全性。旁路途径是C3激活的放大环路,许多因子参与了旁路途径的调节,例如H因子、B因子和D因子。
据不完全统计,目前针对溶血性疾病的小核酸药物研发管线共有近10款,进展 快的由再生元/Alnylam开发的靶向C5的siRNA药物Cemdisiran已经进入临床3期;Arrowhead的靶向C3的siRNA药物ARO-C3进入临床1/2期。此外,我国企业圣因生物、舶望制药、福元医药等均开发了靶向C3的siRNA药物,圣因生物靶向补体C3 的siRNA-GalNAc 结合物进入临床1期,其他企业的项目处于临床前开发。
Cemdisiran是再生元与Alnylam Pharmaceuticals联合开发的一种靶向C5补体的RNAi疗法药物。作为一种试验性的、皮下给药的小干扰RNA(RNAi)药物,Cemdisiran与GalNAc结合,能够抑制肝细胞中的C5合成。Cemdisiran是 个靶向补体系统的试验性RNAi治疗药物,其治疗原理是通过RNAi技术,抑制C5的合成,从而减少血管内溶血的发生。
再生元正在开发C5抑制剂“抗体+siRNA”组合疗法来治疗补体介导的疾病,如PNH、重症肌无力等。其中,cemdisiran可以减少C5的产生,pozelimab可以阻断剩余C5的功能,二者共同抑制终端补体活性。该组合疗法的优势在于能够在较低剂量下达到完全、持续的C5抑制,减少给药频率,并且皮下给药方便临床应用。
根据再生元2023年公布的临床数据,在针对初治PNH患者的关键3期临床研究中,pozelimab+cemdisiran组合疗法几乎可以降低所有患者的乳酸脱氢酶(LDH)水平。而在此之前,没有其他疗法可以降低并维持平均LDH水平到正常水平。在研究主要终点上,该联合疗法可以将LDH水平降至0.8x正常值上限(ULN),而对照组为1.2xULN。从第8周到第26周,91%接受联合治疗的患者维持了足够的LDH控制,而接受对照药治疗的患者为73%。
ClinicalTrials官网信息显示,在国际上,再生元的pozelimab和cemdisiran联合疗法正在进行两项针对PNH适应症的3期研究:一项为评估该联合疗法在PNH成人患者中的长期安全性、耐受性和有效性(ACCESS-EXT);另一项为评估该联合疗法在既往或近期未接受过补体抑制剂治疗的PNH成人患者中的疗效和安全性(ACCESS-1)。本次获得CDE临床默示许可意味着该联合疗法也将在中国开展临床试验。
ARO-C3通过Arrowhead专有的TRiM™平台进行开发,通过RNA干扰机制沉默致病基因,与编码C3蛋白的mRNA结合,抑制C3蛋白的表达。由于C3蛋白在补体信号通路中位于C5蛋白的上游,其在治疗多种补体介导疾病中具有潜力。
目前ARO-C3正在进行一项1/2期、安慰剂对照、剂量递增的研究AROC3-1001(NCT05083364),分为两部分: 部分旨在评估ARO-C3在42名成年健康志愿者的安全性、耐受性、药代动力学和药效动力学;第二部分旨在评估42名患有阵发性夜间血红蛋白尿(PNH)或补体介导的肾病的成年患者的安全性、耐受性、药代动力学和药效动力学。
2023年3月,Arrowhead Pharmaceuticals, Inc.宣布了正在进行的ARO-C3的1/2期临床研究AROC3-1001 部分的中期结果。该公司的研究性RNA干扰(RNAi)疗法ARO-C3旨在减少补体3(C3)的产生,是各种补体介导疾病的潜在疗法。
在AROC3-1001的 部分,ARO-C3的中期结果包括:
AH50的剂量依赖性降低,AH50是替代补体途径溶血活性的一个标志,在 高剂量测试时平均降低91%。
安全性和耐受性:总的来说,未出现临床异常实验室数值;没有剂量限制性毒性,严重不良事件,或因不良事件而中止研究; 常见的不良事件包括头痛、COVID-19、一般轻微的注射部位反应和季节性过敏。


 医无忧服务热线:
医无忧服务热线:
