 400-028-6288
400-028-6288 在线客服
在线客服
 官方微信
官方微信
 400-028-6288
400-028-6288 在线客服
在线客服
 官方微信
官方微信

全部名称:
维奈克拉、维奈托克、唯可来、Venclyxto、Venetoclax、Venclexta
适应症:
1、慢性淋巴细胞白血病/小淋巴细胞淋巴瘤 2、急性髓性白血病
 海外直邮
海外直邮 药师指导
药师指导 隐私服务
隐私服务 签订合同
签订合同
(以下内容仅供参考,具体用药详情请谨遵医嘱)
适应症
1、慢性淋巴细胞白血病/小淋巴细胞淋巴瘤
维奈克拉片(Venetoclax)适用于治疗患有慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)的成人患者。
2、急性髓性白血病
维奈克拉片(Venetoclax)适用于与阿扎胞苷、地西他滨或低剂量阿糖胞苷联合治疗75岁及以上的新诊断急性髓性白血病(AML),或患有妨碍使用强化诱导化疗的合并症的成人。
剂型和规格
表:维奈克拉片(Venetoclax)片剂含量和描述

用法用量(具体用药详情请谨遵医嘱)
1、重要安全信息
评估肿瘤溶解综合征(TLS)风险水平的患者特异性因素,并在首次服用维奈克拉片(Venetoclax)前向患者提供预防性水化和抗高尿酸血症治疗,以降低TLS风险。
2、慢性淋巴细胞白血病/小淋巴细胞淋巴瘤的推荐剂量
维奈克拉片(Venetoclax)给药从5周的剂量递增开始。5周递增给药方案旨在逐渐降低肿瘤负荷(减负荷)和TLS风险。
1)维奈克拉片(Venetoclax)5周剂量递增计划
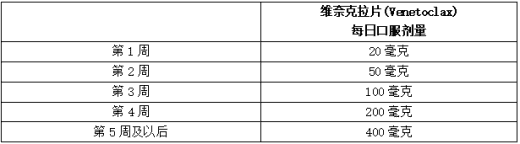
按照5周递增给药方案服用维奈克拉片(Venetoclax),每日一次,每次400毫克,推荐剂量见下表。
表:CLL/SLL病患者5周恢复期的给药方案
2)与奥滨尤妥珠单抗联合用药
在第1个周期第1天开始服用100毫克奥滨尤妥珠单抗,然后在第1个周期第2天开始服用900毫克。在第1个周期的第8和15天以及随后每个28天周期的第1天服用1000毫克,共6个周期。
在第1个周期第22天,根据5周递增给药时间表开始使用维奈克拉片(Venetoclax)。在第2个周期第28天完成上升阶段后,继续服用维奈克拉片(Venetoclax),从第3个周期第1天开始,每天一次,每次400毫克,口服,直至第12个周期的最后一天。
3)与利妥昔单抗联合用药
在患者完成为期5周的维奈克拉片(Venetoclax)强化给药方案并接受维奈克拉片(Venetoclax)(推荐剂量,400毫克,每日一次,持续7天)治疗后,开始利妥昔单抗给药。在每个28天周期的第1天给予利妥昔单抗,共6个周期,第1周期静脉注射375毫克/平方米,第2-6周期静脉注射500毫克/平方米。从利妥昔单抗第1周期第1天开始,持续24个月,每日一次,口服维奈克拉片(Venetoclax)400毫克。
完成5周递增给药方案后,维奈克拉片(Venetoclax)的推荐剂量为400毫克,每日一次。继续使用维奈克拉片(Venetoclax),直至疾病进展或出现不可接受的毒性。
3、急性髓性白血病推荐剂量
维奈克拉片(Venetoclax)的推荐剂量和增加量取决于联合用药。遵循给药方案,包括3天或4天剂量递增,如下表所示。从第1周期第1天开始服用维奈克拉片(Venetoclax),同时使用以下药物:
a.阿扎胞苷75毫克/平方米,静脉或皮下注射,在每个28天周期的第1-7天每日一次;或
b.地西他滨20毫克/平方米,静脉注射,在每个28天周期的第1-5天每日一次;或
c.阿糖胞苷20毫克/平方米,皮下注射,在每个28天周期的第1-10天每日一次。
表:急性AML患者3天或4天上升期的给药方案

继续维奈克拉片(Venetoclax)联合阿扎胞苷或地西他滨或小剂量阿糖胞苷治疗,直至疾病进展或出现不可接受的毒性。
4、肿瘤溶解综合征的风险评估和预防
接受维奈克拉片(Venetoclax)治疗的患者可能会出现肿瘤溶解综合征(TLS)。评估TLS风险水平的患者特异性因素,并在首次服用维奈克拉片(Venetoclax)前向患者提供预防性水化和抗高尿酸血症治疗,以降低TLS风险。
1)慢性淋巴细胞白血病/小淋巴细胞淋巴瘤
维奈克拉片(Venetoclax)可导致肿瘤快速缩小,因此在最初的5周加速期对TLS构成风险。与需要及时管理的TLS一致的血液化学变化最早可能在第一次服用维奈克拉片(Venetoclax)后6至8小时内以及每次剂量增加时发生。在中断给药后恢复维奈克拉片(Venetoclax)治疗时也可能发生TLS。中断后维奈克拉片(Venetoclax)的剂量调整见下表。
TLS的风险是一个基于多种因素的连续统一体,特别是肾功能降低(肌酐清除率[CLcr]<80毫升/分钟)和肿瘤负荷;脾肿大也可能增加TLS的风险。
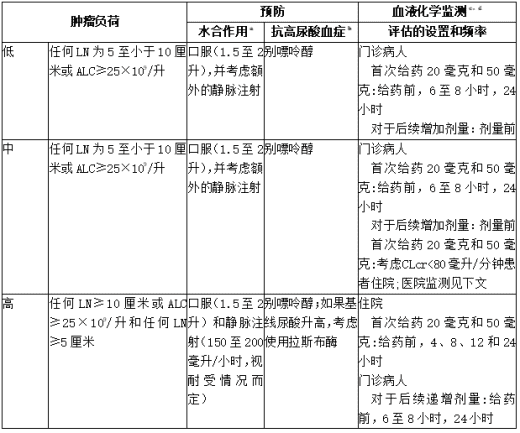
进行肿瘤负荷评估,包括影像学评估(如CT扫描),评估所有患者的血液化学(钾、尿酸、磷、钙和肌酐),并在开始使用维奈克拉片(Venetoclax)治疗前纠正已存在的异常。随着肿瘤负荷的降低,风险可能降低。
根据临床试验数据中的肿瘤负荷测定,下表描述了维奈克拉片(Venetoclax)治疗期间推荐的TLS预防和监测方法。在最终确定预防和监测时间表之前,考虑所有患者合并症。
在剂量中断后重新开始维奈克拉片(Venetoclax)治疗时(在加速期持续1周以上,或在加速完成后持续2周以上),重新评估TLS的风险。根据需要进行预防和监测。
表:根据CLL/SLL患者的肿瘤负荷推荐TLS预防

2)急性髓性白血病
a.开始静脉滴注之前,所有患者的白细胞计数应低于25×109/升。治疗前可能需要进行细胞减灭术。
b.首次服用维奈克拉片(Venetoclax)之前,为所有患者提供预防措施,包括充足的水化和抗高尿酸血症药物,并在上升期继续服用。
c.开始维奈克拉片(Venetoclax)治疗前,评估血液化学(钾、尿酸、磷、钙和肌酐)并纠正已存在的异常。
d.在给药前、增加剂量期间每次新给药后6至8小时以及达到最终剂量后24小时监测TLS的血液化学性质。
e.对于存在TLS风险因素的患者(如循环原始细胞、白血病累及骨髓的高负荷、预处理乳酸脱氢酶[LDH]水平升高或肾功能降低),考虑采取额外措施,包括增加实验室监测和减少维奈克拉片(Venetoclax)起始剂量。
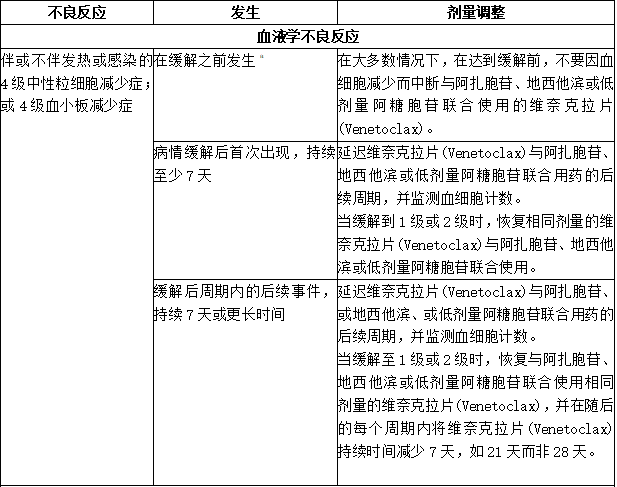
5、不良反应剂量调整
1)慢性淋巴细胞白血病/小淋巴细胞淋巴瘤
下表提供了针对不良反应的维奈克拉片(Venetoclax)建议剂量修改量和针对不良反应的维奈克拉片(Venetoclax)建议剂量减少量。
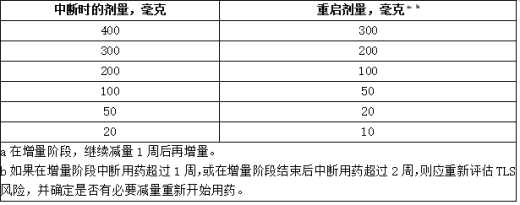
对于在剂量递增阶段中断时间超过1周或在完成递增后超过2周的患者,重新评估TLS的风险,以确定是否有必要以减少的剂量重新开始(例如,剂量递增时间表的所有或某些水平)。
表:针对CLL/SLL不良反应的推荐维奈克拉片(Venetoclax)剂量调整a
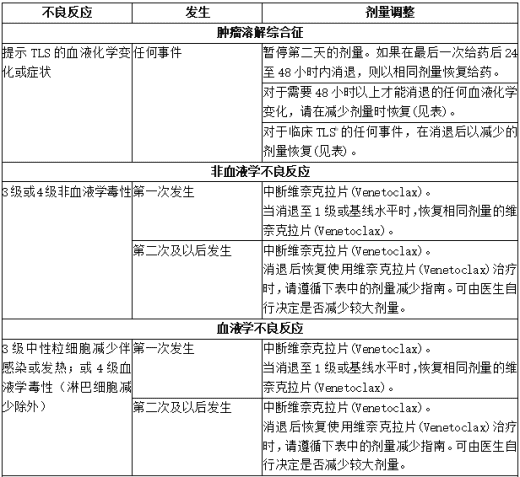

表:针对CLL/SLL中维奈克拉片(Venetoclax)的不良反应建议减少剂量
2)急性髓性白血病
通过血细胞减少症的消退,频繁监测血细胞计数。血细胞减少症的剂量调整和中断取决于缓解状况。下表列出了维奈克拉片(Venetoclax)对不良反应的剂量调整。
表:针对AML不良反应的推荐维奈克拉片(Venetoclax)剂量调整

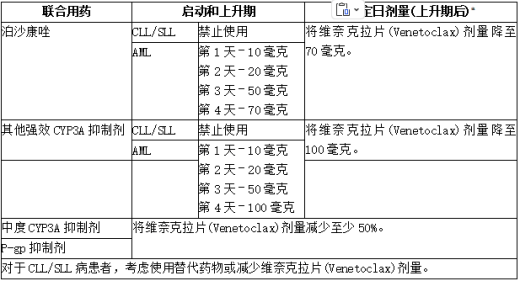
6、药物相互作用的剂量调整
1)强或中度CYP3A抑制剂或P-gp抑制剂
下表描述了在升高期开始、期间或之后,基于与强或中度CYP3A抑制剂或P-gp抑制剂合用的维奈克拉片(Venetoclax)禁忌症或剂量调整。
停用强或中度CYP3A抑制剂或P-gp抑制剂2至3天后,恢复联合用药前的维奈克拉片(Venetoclax)剂量。
表:与CYP3A和P-gp抑制剂的潜在维奈克拉片(Venetoclax)相互作用的管理
7、重度肝功能损害患者的剂量调整
对于严重肝功能损害的患者,将每日一次的维奈克拉片(Venetoclax)剂量减少50%(Child-Pugh C);更密切地监测这些患者的不良反应。
8、管理
指导患者以下事项:
1)随餐服用维奈克拉片(Venetoclax),并饮水。
2)每天大约在同一时间服用维奈克拉片(Venetoclax)。
3)吞下整个维奈克拉片(Venetoclax)药片。吞咽前不要咀嚼、压碎或打碎药片。
维奈克拉片(Venetoclax)的推荐剂量可以使用任何经批准的片剂剂型(例如,根据需要,患者可以服用2×50毫克片剂或10×10毫克片剂,而不是1×100毫克片剂)。
如果患者在通常服用维奈克拉片(Venetoclax)的8小时内错过了该剂量,则指导患者尽快服用错过的剂量,并恢复正常的每日给药计划。如果患者错过给药时间超过8小时,则指导患者不要服用错过的剂量,并在第二天恢复通常的给药计划。
如果患者在给药后呕吐,则指示患者当天不要服用额外剂量,并在通常时间服用下一个处方剂量。
不良反应
维奈克拉通常是指维奈克拉片,其不良反应主要包括胃肠道反应、皮疹、中性粒细胞减少、血小板减少、外周血肿等。患者应严格遵医嘱用药,禁忌自行应用,以免出现药物不良反应,影响身体健康。
1、胃肠道反应:机体应用维奈克拉片后,药物可能会对胃肠道黏膜造成刺激,引起胃肠道反应,常表现为恶心、呕吐、腹泻、便秘等。
2、皮疹:若机体对维奈克拉片过敏,应用后可能会发生过敏反应,常表现为皮疹,导致皮肤上出现很多红色疙瘩,一般还会伴有瘙痒表现。
3、中性粒细胞减少:维奈克拉片属于化疗类药物,临床上一般用于治疗急性髓系白血病,使用后可能会使骨髓功能受到抑制,出现中性粒细胞下降。
4、血小板减少:维奈克拉片可能会抑制骨髓功能,血细胞生长分化速度减慢,从而导致血小板降低,容易引发机体出血。
5、外周水肿:应用维奈克拉片后,可能会导致体液积聚在血管外组织间隙,出现外周水肿的副作用。
6、其他:维奈克拉片还可能导致机体出现贫血、肺炎、脓毒症等不良反应,如维奈克拉片可能会抑制骨髓功能,导致血液中红细胞数量减少,出现贫血副作用,常表现为乏力、疲劳等症状。
若机体应用维奈克拉片后出现以上副作用,可以前往全科医疗科,在医生指导下进行血常规、CT等检查明确诊断,遵医嘱暂停药物或更换其他药物继续治疗。
注意事项
1、肿瘤溶解综合征
接受维奈克拉片(Venetoclax)治疗的患者发生了肿瘤溶解综合征(TLS),包括致死事件和需要透析的肾衰竭。
维奈克拉片(Venetoclax)可导致肿瘤快速缩小,因此在开始时、所有患者的上升期以及CLL/SLL患者中断给药后的重新开始期间对TLS构成风险。与需要及时管理的TLS一致的血液化学变化最早可能在第一次服用维奈克拉片(Venetoclax)后6至8小时内以及每次剂量增加时发生。单次服用20毫克剂量的维奈克拉片(Venetoclax)后,曾有发生TLS(TLS)的报告,包括出现致死病例。
在遵循当前(5周)剂量递增和TLS预防和监测措施的CLL/SLL患者中,维奈克拉片(Venetoclax)CLL/SLL单药治疗试验中的TLS发生率为2%。TLS的发生率与维奈克拉片(Venetoclax)联合奥滨尤妥珠单抗或利妥昔单抗治疗的发生率保持一致。在CLL/SLL患者中,随着2至3周剂量的增加和更高的起始剂量,TLS发生率为13%,包括死亡和肾衰竭。
在遵循当前3天强化给药方案及TLS预防和监测措施的AML患者中,接受文克莱XTA联合阿扎胞苷(VIALE-A)治疗的患者TLS发生率为1.1%。在遵循4天强化给药方案和TLS预防及监测措施的AML患者中,TLS发生率为5.6%,包括接受静脉注射XTA联合低剂量阿糖胞苷(VIALE-C)治疗的患者的死亡和肾衰竭。
TLS的风险是一个基于多种因素的连续统一体,尤其是肾功能降低、肿瘤负荷和恶性肿瘤类型。脾肿大也可能增加CLL/SLL患者发生TLS的风险。
评估所有患者的风险,并提供适当的TLS预防措施,包括水化和抗高尿酸血症。监测血液化学成分并及时处理异常情况。随着总体风险的增加,采取更强化的措施(静脉补液、频繁监测、住院治疗)。如果需要,中断给药;重新开始维奈克拉片(Venetoclax)治疗时,请遵循剂量修改指南。维奈克拉片(Venetoclax)与P-gp抑制剂或强或中度CYP3A抑制剂同时使用会增加维奈克拉片(Venetoclax)的暴露量,这可能会增加维奈克拉片(Venetoclax)起始阶段和升速阶段发生TLS的风险。对于CLL/SLL患者,禁止在开始时和5周的加速期将维奈克拉片(Venetoclax)与强效CYP3A抑制剂联合用药。对于AML患者,在开始与强效CYP3A抑制剂联合用药时以及在3天或4天的加速期,应减少维奈克拉片(Venetoclax)的剂量。对于CLL/SLL病或AML患者,当与中度CYP3A4抑制剂或P-gp抑制剂联合用药时,应减少维奈克拉片(Venetoclax)的剂量。
2、嗜中性白血球减少症
在CLL病患者中,当联合使用文克莱XTA和单一疗法治疗时,63%至64%的患者出现3级或4级中性粒细胞减少症,31%至33%的患者出现4级中性粒细胞减少症。4%至6%的患者出现发热性中性粒细胞减少。
在AML患者中,95%至100%接受维奈克拉片(Venetoclax)联合阿扎胞苷、地西他滨或低剂量阿糖胞苷治疗的患者的基线中性粒细胞计数恶化。
中性粒细胞减少症可随后续周期复发。
在整个治疗期间监测全血细胞计数。对于严重中性粒细胞减少症的维奈克拉片(Venetoclax)中断给药和恢复给药。考虑支持性措施,包括抗菌药物和生长因子(如G-CSF)。
3、感染
使用维奈克拉片(Venetoclax)治疗的患者发生了致命性和严重的感染,如肺炎和脓毒症。
监测患者感染的体征和症状,并及时治疗。对于3级和4级感染,停用维奈克拉片(Venetoclax),直至解决。
4、免疫接种
在使用维奈克拉片(Venetoclax)治疗之前、期间或之后,请勿给予减毒活疫苗,直至B细胞恢复。尚未研究在维奈克拉片(Venetoclax)治疗期间或之后使用减毒活疫苗免疫的安全性和有效性。建议患者接种疫苗可能效果不佳。
5、胚胎-胎儿毒性
根据在动物中的发现及其作用机制,当对孕妇给药时,维奈克拉片(Venetoclax)可能会对胚胎-胎儿造成伤害。在一项在动物中进行的胚胎-胎儿研究中,以与在患者中观察到的剂量(每日400毫克)相当的暴露量向妊娠动物给药静脉曲塞,导致胚胎着床后丢失和胎仔重量下降。
告知孕妇对胎儿的潜在风险。告知有生殖潜力的女性在使用维奈克拉片(Venetoclax)治疗期间和最后一次给药后30天内使用有效避孕方法。
6、在硼替佐米和地塞米松中加入维奈克拉片(Venetoclax)后,多发性骨髓瘤患者的死亡率增加
在一项针对复发或难治性多发性骨髓瘤患者的随机试验(BELLINI;NCT02755597)中,在硼替佐米加地塞米松的基础上加用维奈克拉片(Venetoclax)(维奈克拉片(Venetoclax)并不适用)会导致死亡率升高。在对照临床试验之外,不建议使用维奈克拉片(Venetoclax)联合硼替佐米加地塞米松治疗多发性骨髓瘤患者。
特殊人群用药
1、妊娠期
根据在动物中的研究结果及其作用机制,当对孕妇给药时,维奈克拉片(Venetoclax)可能会对胚胎-胎儿造成伤害。没有关于孕妇使用维奈克拉片(Venetoclax)的可用数据来告知药物相关风险。根据AUC,在器官形成期给妊娠动物服用维奈克拉片(Venetoclax),其暴露量为人体暴露量的1.2倍,推荐剂量为每天400毫克。告知孕妇胎儿可能面临的风险。
2、哺乳期
尚无关于母乳中是否存在维奈克拉片(Venetoclax)或其对母乳喂养的婴儿或产奶量的影响的数据。当对泌乳动物给药时,乳汁中存在维奈克拉片(Venetoclax)。
由于母乳喂养的儿童可能出现严重的不良反应,因此建议女性在接受维奈克拉片(Venetoclax)治疗期间以及末次给药后1周内不要进行母乳喂养。
3、具有生殖潜力的男性和女性
维奈克拉片(Venetoclax)在对孕妇给药时可能会对胎儿造成伤害。
在开始维奈克拉片(Venetoclax)治疗之前,验证具有生殖潜力的女性的妊娠状态。
告知有生殖潜力的女性在使用维奈克拉片(Venetoclax)治疗期间和最后一次给药后30天内使用有效避孕方法。
根据动物研究结果,维奈克拉片(Venetoclax)可能会损害男性生育力。
4、儿童使用
尚未确定维奈克拉片(Venetoclax)在儿科患者中的安全性和有效性。
5、老年用药
1)慢性淋巴细胞白血病/小淋巴细胞淋巴瘤
在之前接受过CLL/SLL治疗的352名患者中,根据3项维奈克拉片(Venetoclax)单药治疗开放标签试验进行的安全性评估显示,57% (201/352)的患者年龄≥65岁,18% (62/352)的患者年龄≥75岁。在联合治疗和单一治疗研究中,未观察到老年患者和青年患者之间在安全性和有效性方面有临床意义的差异。
2)急性髓性白血病
在VIALE-A中接受维奈克拉片(Venetoclax)联合阿扎胞苷治疗的283例患者中,96%的患者年龄≥65岁,60%的患者年龄≥75岁。
在M14-358中接受维奈克拉片(Venetoclax)联合地西他滨治疗的13例患者中,100%的患者年龄≥65岁,62%的患者年龄≥75岁。
在VIALE-C中接受维奈克拉片(Venetoclax)联合小剂量阿糖胞苷治疗的142例患者中,92%的患者年龄≥65岁,57%的患者年龄≥75岁。
在AML患者中进行的维奈克拉片(Venetoclax)临床研究未包括足够数量的年轻人,无法确定65岁及以上患者的反应是否与年轻人不同。
6、肾功能损害
由于TLS的风险增加,肾功能降低(CLcr<80毫升/分钟,按科克罗夫特-高尔特公式计算)的患者在开始使用维奈克拉片(Venetoclax)治疗时,需要更强化的预防和监测以降低TLS的风险。
对于轻度、中度或重度肾功能损害(CLcr≥15毫升/分钟)的患者,不建议调整剂量。
7、肝功能损害
对于轻度(Child-Pugh A)或中度(Child- Pugh B)肝功能损害的患者,不建议调整剂量。
对于严重肝功能损害的患者,减少维奈克拉片(Venetoclax)的剂量(Child-Pugh C);更频繁地监测这些患者的不良反应。
禁忌症
1.对维奈克拉或其配方中任何成分有已知过敏史的患者禁用
2.未解决的肿瘤溶解综合症TLS是维奈克拉治疗的一个潜在风险,患者在治疗前禁用
3.肝功能严重损伤
在使用维奈克拉之前,患者需要进行肝功能检查,以评估肝脏功能是否正常。对于具有严重肝功能损伤的患者,维奈克拉的使用可能会导致进一步的损害,因此应该避免使用。如果肝功能损伤程度轻微或中度,医生可能会调整剂量或监测患者的肝功能。
4.与CYP3A4的相互作用
维奈克拉通过抑制CYP3A4酶来发挥治疗作用。CYP3A4是一种参与药物代谢的酶,在许多药物中发挥重要作用。因此,在使用维奈克拉时,患者应告知医生正在使用的所有药物,包括非处方药和保健品。某些药物可能与维奈克拉相互作用,影响它的疗效或增加副作用的风险。医生会根据这些相互作用调整维奈克拉的剂量或考虑其他治疗选择。
5. 妊娠期间的使用
维奈克拉对于孕妇来说可能是有害的。根据对动物的研究结果,维奈克拉可能对胎儿产生不良影响。因此,在妊娠期间禁止使用维奈克拉。如果患者怀孕或计划怀孕,应及时告知医生,以便根据具体情况考虑其他治疗方案。
6.哺乳期间的使用
有关维奈克拉在哺乳期间的使用安全性的研究仍然有限。由于维奈克拉可能通过乳汁分泌,对婴儿产生不确定的影响,因此在哺乳期间不建议使用维奈克拉。如果患者正在哺乳或计划哺乳,应与医生讨论其他治疗选择和喂养方式。
维奈克拉是一种有效的药物,用于治疗白血病和淋巴瘤。在使用维奈克拉之前,患者和医生需要共同评估其禁忌事项,以确保患者的安全和治疗效果。肝功能严重损伤、与CYP3A4的相互作用、妊娠期间的使用以及哺乳期间的使用都是维奈克拉的禁忌事项,需要特别留意。
在治疗过程中,患者应与医生保持密切沟通,及时告知有关自己的任何变化或疑虑。严格遵循医生的建议和配合医生监测。
药物过量
维奈克拉片(Venetoclax)没有特效解毒剂。对于用药过量的患者,应密切监测并提供适当的支持治疗;在增量阶段中断维奈克拉片(Venetoclax),并仔细监测 TLS 的体征和症状以及其他毒性反应。基于维奈克拉片(Venetoclax)的大分布容积和广泛的蛋白结合,透析不太可能显著清除维奈克拉片(Venetoclax)。
成分
活性成分:venetoclax
非活性成分:共聚维酮、胶体二氧化硅、聚山梨酯80、硬脂富马酸钠和磷酸氢钙。
10毫克和100毫克包衣片剂还包括:氧化铁黄、聚乙烯醇、聚乙二醇、滑石粉和二氧化钛。
50毫克包衣片剂还包括:氧化铁黄、氧化铁红、氧化铁黑、聚乙烯醇、滑石粉、聚乙二醇和二氧化钛。
性状
片剂
贮存方法
1、将维奈克拉片(Venetoclax)储存在30°C或以下。
2、将维奈克拉片(Venetoclax)保存在其原始容器中,以防受潮。
3、对于CLL或SLL患者,在治疗的前4周,请将维奈克拉片(Venetoclax)片剂保存在原包装中。请勿将药片转移到其他容器中。
4、将维奈克拉片(Venetoclax)和所有药物放在儿童拿不到的地方。
上一篇:恩西地平(Enasidenib)
下一篇:格列卫(Imatinib)


 医无忧服务热线:
医无忧服务热线:
