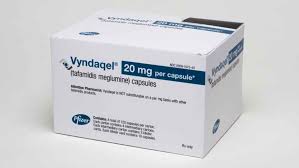
Vyndaqel是一种转甲状腺素蛋白稳定剂,可用于延迟转甲状腺素蛋白淀粉样变性引起的神经损害。欧委会于2011年11月16日批准了Vyndaqel在整个欧盟的上市许可。
药品称呼
通用名:Tafamidis
商品名:Vyndaqel
全部名称:氯苯唑酸葡胺软胶囊,维达全,Tafamidis,Vynmac,Vyndaqel,tafamidis meglumine
规格
20mg;61mg
禁忌
对活性成份或其中的任何辅料过敏者禁用。
贮藏
储存在20°C至25°C(68°F至77°F)的受控室温下;允许温度为15°C至30°C(59°F至86°F)
作用机制
转甲状腺素蛋白淀粉样变是一种罕见病,其特征为患者体内存在有缺陷的血液蛋白,即转甲状腺素蛋白(TTR)。这种缺陷蛋白容易破裂,由此导致患者体内出现纤维样物质(淀粉样蛋白原纤维)沉积。淀粉样蛋白原纤维的沉积会对组织和器官造成损害,影响它们的正常功能[5]。当病变累及神经时,该病便被称为转甲状腺素蛋白家族性淀粉样多发性神经病(TTR-FAP)。
Vyndaqel中的活性物质tafamidis是转甲状腺素蛋白稳定剂。它附着于缺陷蛋白,即转甲状腺素蛋白,并使其稳定。通过这种方式,它可以阻止转甲状腺素蛋白分解,进而防止淀粉样蛋白原纤维的形成并延缓神经疾病的进展。
安全与疗效
基于一项随机、双盲、安慰剂对照研究(Fx-005),欧盟药品监督管理局(EMA)批准了Vyndaqel(tafamidis)用于治疗转甲状腺素蛋白淀粉样多发性神经病(TTR-FAP)。这项研究持续了18个月,共涉及128名患者,所有入组患者均携带V30M基因突变,且疾病早期便表现出相关症状(行走需要额外的辅助)。
在91位患者中,有86位患者在完成18个月的治疗后,继续入组了一项持续12个月的开放标签扩展研究。 在延长期内,观察到患者下肢神经损害评分(NIS-LL)的改变与在前18个月内接受Vyndaqel(tafamidis)治疗的患者相似。完成18个月治疗期后,患者的下肢神经功能评估结果为:下肢神经损伤缓解比率为(缓解患者/患者总数): Vyndaqel(tafamidis)组:60.0%;安慰剂组:38.1%。与基线状态相比,完成18个月治疗的患者,其TQOL评分变化为:
Vyndaqel(tafamidis)组:0.1(±2.98);安慰剂组:8.9(±3.08)。另外,其他衡量指标也证实了Vyndaqel(tafamidis)的治疗效果,与安慰剂相比, Vyndaqel(tafamidis)能够减缓神经功能的恶化并改善患者的营养状况。
温馨提示
1.本站提供的医学产品信息并不完整,不能代替有资格的医疗专业人士所提供的咨询意见,相关问题请咨询您的主治医生获得更多的帮助。本站内容作为纯介绍性信息仅供参考。
2.本站内容如有错误请联系客服修正,感谢您的支持和反馈!
3.更多药品相关问题及靠谱仿制药渠道,请咨询客服了解!
 400-028-6288
400-028-6288 在线客服
在线客服
 官方微信
官方微信


 医无忧服务热线:
医无忧服务热线:

















 海外直邮
海外直邮