 400-028-6288
400-028-6288 在线客服
在线客服
 官方微信
官方微信
 400-028-6288
400-028-6288 在线客服
在线客服
 官方微信
官方微信

新闻动态
2024 年6月22日发表于美国临床皮肤病学杂志
Kimmtrak/tebentafusp(葡萄膜黑色素瘤药物)说明书
摘要
与皮肤黑色素瘤 (CM) 相比,葡萄膜黑色素瘤 (UM) 在遗传上是一种独特的肿瘤,由于其突变负担低,免疫系统对其的感知能力要弱得多。因此,彻底改变 CM 治疗的治疗方法在转移性 UM 中仍然普遍无效,或仅在一小部分患者中有效。为此,免疫检查点阻断的治疗益处非常有限,并且可能以严重的免疫相关不良事件为代价,这些不良事件可能会影响所有器官系统。值得注意的是,tebentafusp 是一种全新的抗癌药物,已获得官方授权用于治疗转移性 UM。它是 种在转移性 UM 患者随机对照试验中显示出生存优势的药物。尽管具有生存优势并获得批准,但 tebentafusp 仅限于 HLA-A*02:01 阳性患者,客观反应率低,表明仍然需要额外的治疗方法。因此,肝脏导向疗法通常用于控制肝转移的肿瘤,是肝脏主导疾病日常管理的核心支柱。此外,不依赖 MEK 抑制剂的靶向疗法(例如 darovasertib 和 crizotinib 的组合)的有希望的数据为未来转移性 UM 的更多选择带来了希望。这篇叙述性综述及时全面地概述了转移性 UM 的当前治疗前景。
1 葡萄膜黑色素瘤的简介和遗传背景
葡萄膜黑色素瘤 (UM) 是成人中 常见的眼部恶性肿瘤,但它是一种孤儿肿瘤,白种人群体中年龄调整后平均发病率为每百万 5.2 人。对于较大的肿瘤,仍建议进行眼球摘除术,但近年来,原发性肿瘤的局部治疗取得了重大进展。对于较小的肿瘤,通过近距离放射治疗/斑块放射治疗、立体定向放射治疗、质子束治疗或内切除术等方法可保留眼睛及其部分残存的视功能。然而,这些原发性肿瘤局部治疗的改进并未影响远处转移的发生或总体生存期 (OS)。根据原发性肿瘤的遗传背景,至少 50% 的患者会发生转移,主要发生在肝脏。一旦发生转移,生存率就会迅速下降,从 1 年时的 52% 下降到 2 年时的 25%,再到 3 年时的 13%。
UM 是一种独特的肿瘤实体,应严格与皮肤黑色素瘤 (CM) 区分开来。根据癌症基因组图谱 (TCGA),CM 可根据以下致癌基因的特定遗传变异分为四种不同的基因组亚型:BRAF、RAS (N/H/K)、NF1 和这三种基因的野生型 (wt)(称为“三重”wt)。有趣的是,除了三重 wt 亚型外,超过 90% 的 CM 显示出明显的紫外线 (UV) 辐射暴露特征。这表明紫外线辐射在这些亚型的发展中起着重要作用。
与 CM 相反,UM 肿瘤表现出独特的突变谱,突变负担非常低,突变率为每兆碱基 0.46 个,平均每个肿瘤 32个编码突变,没有紫外线辐射突变特征。Robertson 等人基于 TCGA 数据将 UM 分为四类:3 二体伴有 EIF1AX 突变,预后良好,3 二体和 SF3B1 突变,预后中等,3 单体和 BAP1 突变,预后不良,可进一步分为两个亚组,每个亚组都表现出独特的基因组畸变和转录特征。
3单体性肿瘤与较差的无病生存期 (DFS) 和 OS 相关,而 3二体性肿瘤则倾向于发展有限的转移并延长 DFS。UM 中观察到的 常见的体细胞突变是 GNAQ 和 GNA11,导致丝裂原活化蛋白激酶 (MAPK) 通路持续激活,从而促使 UM 发展。然而,这些突变似乎对 OS 并没有显著影响。此外,在 3单体性肿瘤中已发现 BAP1 基因的半合子突变,导致 BAP1 表达缺失或功能障碍 。进一步的研究还表明, BAP1 突变肿瘤与摘除眼球后 2 年临床检测到的转移高峰之间存在密切关联。此外,在 3二体性肿瘤中发现了 SF3B1 和 EIF1AX 的体细胞突变,并且与更有利的疾病过程相关。SF3B1 突变与 DFS 延长和 7 年后转移峰值延迟相关。EIF1AX 突变以及 wt BAP1、SF3B1 和 EIF1AX 基因与良好的生存率相关。因此,无论治疗方案如何,肿瘤的特定遗传背景(基因型)在确定整体预后方面起着关键作用。迄今为止,UM 中 直接和与预后 相关的鉴别仍然是存在或不存在 3单体性。
有证据表明,高突变负荷可预测对免疫检查点阻断 (ICB) 的阳性反应。在转移性 UM 中,与 MBD4 相关的超突变表型对抗程序性细胞死亡蛋白 1 (抗 PD-1) 疗法表现出异常的敏感性,这种疗法仅在多达 2% 的 UM 患者中存在。此外,有研究表明,由于剪接产生的新表位,具有 SF3B1 突变的肿瘤对 ICB 的敏感性增加 。这些发现表明遗传和突变特征在指导 UM 治疗决策和预测反应方面具有潜在重要意义。
然而,低突变负荷使 UM 能够逃避免疫系统并导致快速进展至死亡。与转移性 CM 不同,有效疗法非常有限。因此,当发生转移且不存在防止肿瘤扩散的辅助疗法时,中位生存期会急剧下降。
2 转移性葡萄膜黑色素瘤的全身治疗
2.1 Tebentafusp 和免疫检查点阻断
目前,美国食品药品管理局 (FDA) 和欧洲药品管理局 (EMA) 批准的治疗转移性 UM 的药物是 tebentafusp (tebe) 。Tebe 属于一类新型抗癌药物,称为免疫动员单克隆 T 细胞受体抗癌药 (ImmTAC),旨在治疗 HLA-A*02:01 阳性的转移性或不可切除的 UM 患者。它是一种双特异性分子,结合了亲和力增强的可溶性 T 细胞受体,靶向由主要组织相容性复合体 (MHC) I 类分子呈递的糖蛋白 gp100 的肽序列“YLEPGPVTA”,以及抗 CD3 特异性单链可变片段。因此,tebe 将 T 细胞募集到表达 gp100 的 UM 细胞中,从而产生多功能 T 细胞介导的免疫反应,包括肿瘤特异性细胞杀伤和细胞因子释放。
在关键试验中,经过 3 年的随访,tebe 组的中位 OS 为 21.6个月,而对照组中位 OS 为 16.9个月(对照组接受研究者选择的帕博利珠单抗、伊匹单抗或达卡巴嗪治疗(风险比 [HR] 0.68,95% 置信区间 [CI] 0.54–0.87)。接受 tebe 治疗的患者 1 年、2 年和 3 年的生存率分别为 72%、45% 和 27%,而对照组的生存率分别为 60%、30% 和 18%。一项 II 期研究涉及 127 名接受 tebe 治疗的难治性转移性 UM 患者,结果显示 1 年生存率为 62%(95% CI 53–70),中位 OS 为 16.8个月(95% CI 12.9–21.3),这表明后期治疗有潜在获益。此外,数据表明早期减少循环肿瘤 DNA (ctDNA) 与 OS 存在相关性。然而,观察到的反应显示出明显的异质性,无论是在患者之间还是在单个患者内的转移瘤之间,但这种异质性的原因尚不清楚或不明显。此外,由于 HLA 限制,只有大约 45%–50% 的患者可以接受这种疗法。
Tebe 与派姆单抗、伊匹单抗或达卡巴嗪单药治疗进行了比较,但未与抗细胞毒性 T 淋巴细胞相关蛋白 4 (anti-CTLA-4) 抗体和抗 PD-1 抗体的双检查点阻断 (DCB) 进行比较。因此,Petzold 等人对现有的全身治疗的 OS 和无进展生存期 (PFS) 进行了全面的荟萃分析,重点比较了 Tebe 和 DCB。这项研究提供了强有力的证据,表明就 OS 而言,Tebe 是转移性 UM 有益的治疗选择。人群调整模型,例如匹配调整间接比较 (MAIC) (HR 0.465,95% CI 0.276–0.781) 和模拟治疗比较 (STC) (HR 0.420,95% CI 0.272–0.647),以及未调整模型 (HR 0.641,95% CI 0.449–0.915),均显示接受 tebe 治疗的患者的生存率明显优于接受 DCB 治疗的患者。通过数字比较汇总生存曲线,tebe 明显优于其他治疗方法:中位 OS 为 22.4个月,而 DCB 显示中位 OS 为 15.7个月。其他治疗组表现较差,中位 OS 范围从 7.7个月(抗 CTLA-4 单药治疗)到 10.9个月(抗 PD-[ l ]-1 单药治疗)。此外,调整倾向评分的分析比较了 DCB 与 tebe,也显示后者具有生存优势 (HR 0.52, 95% CI 0.35–0.78) 。然而,必须强调的是,此项研究仅限于一项 DCB 前瞻性试验,该试验显示 OS 相对较差。
将两项已发表的 DCB 前瞻性单臂试验的未处理数据结果与 Tebe 关键试验的结果进行比较(表1),DCB 的中位 OS 分别为 12.7 和 19.1个月,Tebe 为 21.6个月。DCB 的 1 年生存率分别为 51.9% 和 56%,而 Tebe 的 1 年生存率仅为 73%。另一方面,Tebe 的客观缓解率 (ORR) 为 11%,而 DCB 分别为 11.5% 和 18.2%。鉴于这些关于 Tebe 治疗的数据,无法根据放射学评估的 ORR 预测 OS。
两项涉及 DCB 的前瞻性试验的 OS 有显著差异。Piulats 等人仅招募了未接受过治疗的患者,并报告其 OS(12.7个月 vs. 19.1个月)、PFS(3个月 vs. 5.5个月)和 ORR(11.5% vs. 18.2%)明显低于 Pelster 等人(后者纳入了接受过任意次数治疗的患者)。此外,Piulats 等人招募的东部肿瘤协作组 (ECOG) 体能状态 0 的患者比例更高(84.6% vs. 71%),而乳酸脱氢酶 (LDH) 水平升高的患者比例较低(32% vs. 43%)。矛盾的是,这导致了在基于这些预后参数被认为预后较好的人群中产生不利的结果(OS、PFS、ORR)。就两项研究中观察到的转移模式而言,生存获益可能归因于 Pelster 等纳入了更多患有肝外转移的患者(69% vs. 58%),而仅有肝转移的患者数量较少(31% vs. 42%) 。
我们小组的一系列回顾性分析提供的证据表明,肝转移仅是 OS 的负面预后因素,而肝外疾病则是 OS 改善的预后因素。我们还证明 性肝转移与 ICB 治疗反应较低相关。在另一项研究中,我们可以证明 ICB 的 佳反应,特别是基于实体瘤疗效评价标准 (RECIST) 的部分缓解 (PR),是延长 OS 的有力预后因素 ( p<0.001) 。该观察结果与患者是否接受 PD-1 抑制剂单药治疗或 DCB 无关。我们的研究结果以及其他人的研究结果都强调,与 ICB 单药治疗相比,DCB 的 ORR 更高。此外,我们在另一项研究中证明,对于一小部分晚期 UM 患者(当没有其他治疗选择时),在原发性耐药或出现毒性后再次诱导 ICB 可能会带来临床益处。在另一项回顾性多中心研究中,与 tebe 治疗后接受二线 ICB 治疗的患者相比,ICB 后接受 tebe 治疗的患者 OS 有延长趋势(28个月 vs. 24个月,p=0.257)。
除了疗效之外,免疫治疗方法的毒性也是一个可能限制其使用的重要问题。在使用tebe治疗期间,47%的患者发生了3级或4级治疗相关不良事件(AE)。 常见的不良事件是细胞因子释放综合征(89%), 可能的细胞因子介导的不良事件是发热(76%)、寒战(47%)、恶心(43%)和低血压(38%)。其他常见的不良事件包括皮肤相关不良事件(总结为皮疹,83%)、瘙痒(70%)和疲劳(41%)。然而,大多数不良事件通常发生在治疗的前 4 周内,在递增剂量方案中,剂量从 20 微克开始,然后增加到 30 微克,并在第三周达到推荐的 2 期剂量 68 微克。随着后续剂量的增加,不良事件的发生频率和严重程度会降低。在 2% 的病例中,由于不良事件必须停止治疗。
由于 DCB 广泛激活免疫系统,因此发生严重免疫介导不良反应的风险更高,在 UM 中高达 57.7% 的病例中可导致 3 级或 4 级治疗相关不良反应。这些不良反应可能会影响体内的几乎所有器官系统,包括胃肠道、呼吸系统、心血管、肌肉骨骼、神经系统、肝脏、肾脏、皮肤和血液系统。虽然大多数不良反应可通过及时临床诊断和早期干预完全解决,但值得注意的是,在约 50% 的病例中,免疫相关内分泌毒性是不可逆的。总体而言,DCB 对转移性 UM 的治疗益处主要是不利的,尤其是考虑到相对常见、部分不可逆的严重不良反应。
2.2 肝脏靶向治疗
鉴于肝转移的频繁发生、肝脏的免疫抑制微环境以及缺乏有效的全身治疗,肝脏定向治疗(LDT)常用于晚期 UM。
边界清晰的单发肝脏病变可通过射频或微波消融等介入治疗或手术切除。对于较大的单发病变(>3–4 cm),另一种治疗选择是栓塞手术,例如经动脉化疗栓塞术 (TACE)。尽管如此,缺乏对比临床试验和标准化治疗方案仍构成挑战。对于多发性肝转移瘤,以及根据分布模式和特定位置的治疗方案可用性,通常采用选择性内放射治疗 (SIRT)、肝隔离灌注 (IHP) 和经皮肝灌注 (PHP,也称为化学饱和) 。
在 II 期试验中,SIRT 的中位 OS 为 18.5个月,PFS 为 8.1个月。此外,一项涉及 71 例患者的回顾性分析显示,中位 OS 为 12.3个月,PFS 为 5.9个月。一项包括 11 项研究(9/11 回顾性研究)和 268 例患者的系统评价报告称,OS 为 12.3个月,且 90.9% 的患者大多为低级别(不良事件通用术语标准 [CTCAE] 1-2)不良事件。然而,发生了两例与 SIRT 相关的死亡病例,死因是肝功能衰竭。
PHP 与美法仑联合治疗是一种区域治疗程序,其中将肝脏与体循环隔离,以便通过双球囊导管进行肝脏灌注。随后,抽吸静脉血并通过体外过滤系统净化美法仑,从而减轻全身毒性。Hughes 等在一项包括 93 例患者的随机 III 期研究中证明,与 佳替代治疗 (BAC) 相比,PHP 的肝脏反应和 PFS 显著改善。然而,在这项研究中,由于大约 40% 的患者患有肝外转移,因此无法显示生存益处(PHP 10.6个月 vs. BAC 10个月)。此外,9% (4/44) 的治疗相关死亡发生在 PHP 组,其中大多数与骨髓抑制有关。为降低血液学毒性,建立了改进的过滤系统(第二代 [GEN2])。一项前瞻性 II 期研究仅纳入 35 名肝转移患者,报告 OS 为 19.1个月,无治疗相关死亡。大多数患者出现血液学 3/4 级不良反应,但作者报告其安全性和毒性特征在可接受范围内。Tong 等人进行的另一项回顾性分析中,对 101 名接受 PHP 治疗的转移性 UM 患者分析发现,与疾病进展患者相比,完全缓解 (CR)/PR 或疾病稳定 (SD) 的患者具有显著的生存获益(PD,分别为 27个月、21个月和 8个月)。作者论述了 PHP 治疗的 佳候选人是具有良好的非癌症相关健康状况、无心血管疾病、仅有肝转移的早期原发性 UM 并且 LDH 水平低的患者。另一项 III 期试验 (FOCUS) 比较了 PHP 与 BAC(研究者选择 TACE、帕博利珠单抗、伊匹单抗或达卡巴嗪),包括 144 名患者(102 名 PHP vs. 42 名 BAC),PHP 显示出显著的生存获益(分别为 20.53个月和 14.06个月)。tebe 和 DCB 等全身疗法未包括在内。但是,患者仍在接受生存随访,尚未报道对后续全身疗法的评估。在一项德国双中心回顾性分析中,PHP 显示肝 PFS 中位值为 12.4个月,OS 中位值为 18.4个月。
IHP 包括手术隔离肝脏并将动脉和静脉导管连接到心肺机。随后,用美法仑灌注肝脏 60 分钟。在一项随机、开放标签、多中心 III 期试验 (SCANDIUM 试验) 中,未经治疗的肝转移患者的 PFS 显著改善,持续时间为 7.4个月,而接受化疗 (49%)、ICB (39%) 或其他 LDT (9%) 的对照组的 PFS 为 3.3个月 (p > 0.001) 。19.5% (8/41) 报告了严重不良反应,1 例患者出现治疗相关死亡。 近发表的随访数据报告称,IHC 组的 OS 为 21.7个月,对照组为 17.6个月,HR 为 0.64(95% CI 0.37-1.10)。
一项比较 IHP 和 PHP 的荟萃分析显示,IHP 的中位 OS 为 17.1个月,PHP 的中位 OS 为17.3个月。中位 PFS 分别为 7.2个月和 9.6个月,中位肝脏 PFS 分别为 10个月和 9.5个月。然而,PHP 在可重复性方面占有优势。
在一项比较 PHP 与 SIRT 的单中心研究中,SIRT 的中位 PFS 为 4.25个月,PHP 的中位 PFS 为 13.6个月(p=0.090)。此外,还观察到生存优势,SIRT 的中位 OS 为 10个月,PHP 的中位 OS 为 17.2个月(p=0.006)。
已证明 ICB 与 SIRT 联合治疗可增强治疗反应。与仅接受 ICB治疗的队列相比,接受 ICB 加 LDT 治疗的队列中任何 ICB 治疗的 ORR 均显著更高(16.7% vs. 3.8%,p=0.0073)。此外,联合治疗的队列中 OS 中位数延长(20.1 vs. 13.8个月;p=0.0016)。进一步的回顾性分析将 DCB 和 SIRT 与仅 SIRT 进行了比较,结果显示联合治疗组 OS 显著延长(46.6 vs. 11.8个月,p=0.039)。另一项回顾性研究表明,LDT 联合 ICB 治疗与单纯 ICB 治疗相比具有显著的生存优势(22.5个月 vs. 11.4个月,p=0.036)。此外,一项关于 PHP 联合 DCB 治疗安全性和有效性的开放性、单中心、Ib 期/随机 II 期临床试验目前正在研究中,初步数据显示该治疗具有良好的安全性。
然而,对此类研究的解释和比较应谨慎,因为这些研究可能表现出遵守协议的站点间差异,并且有些是回顾性分析。
2.3 结论
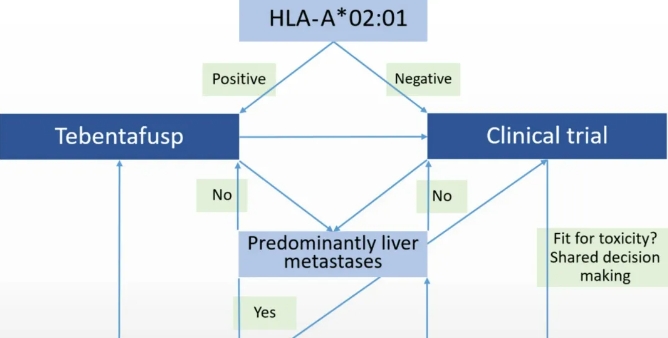
综上所述,我们建议将tebe作为HLA-A*02:01亚型阳性患者的一线治疗(图1)。关键试验表明,肿瘤负荷高(LDH升高)和疾病进展(胆红素和肝酶升高)的患者可能无法从这种治疗中获益。对于仅有肝转移的患者,可以考虑使用SIRT、PHP或IHP等LDT来减轻肿瘤负荷。LDT也可以与tebe同时使用或快速序贯使用,但目前尚无研究探讨这种组合的潜在益处。然而,tebe的“理想”患者是那些一般状况良好、ECOG体能状态低(0或1)、肿瘤负荷低且LDH水平正常的患者。尽早开始治疗似乎至关重要,因为这些患者在 OS 方面表现出 大的益处。尽管 OS 具有临床益处,但 tebe 的 ORR 仍然很低,理想的治疗持续时间通常不明确,缺乏数据和有效的生物标志物来指导何时停止或改变治疗。因此,治疗可以在适度进展后继续进行。在肿瘤快速扩散和生长的情况下,建议停止使用 tebe,并应在跨学科肿瘤委员会内讨论替代治疗方案。
对于 HLA-A*02:01 类型为阴性或对 tebe 有抗药性的患者,临床试验方案的评估至关重要。此外,ICB 目前是 具有潜在可持续临床益处的替代全身疗法。尽管缺乏连续研究(正在研究 NCT05549297),但从肿瘤免疫学角度来看,连续使用 ICB 来刺激 tebe 激活的 T 细胞是合理的。大量证据表明,DCB 是一种比 ICB 单药治疗更有效的治疗选择,无论 AE 风险是否更高。是否继续使用 DCB 的决定应基于患者对潜在毒性的适应性,需要进行彻底的讨论和共同决策。此外,根据当地的可用性,建议评估 ICB 和 LDT 的联合治疗。
3 药物开发方法
转移性 UM 中 GNAQ/GNA11 突变的发生率很高,这表明 MAPK 通路是新治疗方法的合适靶点。抑制蛋白激酶 C (PKC) 通路可下调由 GNAQ/GNA11 突变引起的 MAPK 激活通路。口服 PKC 抑制剂 darovasertib ( LXS196 ) 是同类药物中 个同时抑制蛋白激酶 C 的新型和常规亚型 ( α、β、δ、ϵ、η、θ ) 的药物。在 近发表的一项 I 期研究中,该研究评估了 darovasertib 治疗 68 例转移性 UM 患者的效果,结果显示 6 例患者 (9.1%) 获得临床缓解 (CR/PR),45 例患者 (68.2%) 获得 SD。另一种药物组合将 darovasertib 与 c-MET 抑制剂克唑替尼配对,在一线和经治疗的转移性 UM 中均显示 30% 的确认 PR 和 92% 的肿瘤缩小。值得注意的是,该活性与患者的 HLA 状态无关,研究包括具有相当大肿瘤负担和 LDH 升高的患者。安全性是可控的,主要为 1-2 级 AE(30%),仅 9% 为严重 AE。
另一个有趣的靶点是磷酸肌醇 3-激酶 delta (PI3Kδ),它在白细胞活化和癌症增殖中发挥作用。在一项 I 期研究中,高选择性口服 PI3Kδ 变构调节剂 (roginolisib,IOA-244) 表现出良好的耐受性和一定疗效。该试验涉及实体瘤患者,包括 UM (9/16; 56%)。这些患者的 PR 为 5%,SD 为 80%,表明具有潜在的抗肿瘤活性。具体而言,roginolisib 诱导表型变化,促进 CD8+ 和自然杀伤细胞的浸润,同时减少抑制性免疫细胞的存在。据制造商称,roginolisib 可以通过其免疫调节特性使实体瘤对抗 PD-1 疗法敏感。
另一种实验方法是使用 IMC-F106C 的 ImmTAC 疗法,IMC-F106C 是一种双特异性分子(与 tebe 属于同一类别),它结合了亲和力增强的可溶性 T 细胞受体 (TCR),该受体靶向由 MHC I 类分子呈递的黑色素瘤优先表达抗原 (PRAME) 蛋白的肽序列,以及抗 CD3 特异性单链可变片段。初步数据显示,在 T 细胞活化和耐受性方面取得了令人欣喜的结果。治疗相关的不良反应是可控的,没有发生任何导致治疗中断或死亡的事件。IMC-F106C 的疗效扩展到多种肿瘤类型,包括 UM,显示出可持续长达 9个月的持久反应。具体而言,在 UM 中,50% (3/6) 的未接受过 tebe 治疗的患者出现 PR,其余 50% (3/6) 的患者出现 SD。此外,在接受过 tebe 治疗的患者中,100% (5/5) 的患者观察到 SD。在所有肿瘤类型中,90% 的可评估患者 ctDNA 减少,早期减少与临床益处相关。然而,IMC-F106C 令人鼓舞的早期发现需要在涉及更大患者队列和生存分析的进一步研究中得到证实。
针对肿瘤浸润淋巴细胞 (TIL) (NCT00338377)、RNA 疫苗 (NCT04455620)、G 蛋白偶联雌激素受体 (GPER) 激动剂 (LNS8801、NCT04130516)、转基因单纯疱疹病毒 (RP2、NCT04336241)、血管内皮生长因子 (VEGF) 抑制剂 (lenvatinib、NCT05282901)、淋巴细胞活化基因 3 (LAG-3) 抑制剂 (relatlimab、NCT04552223) 以及进一步的 PKC 抑制剂 (DYP688、NCT05415072) 的进一步临床试验仍在进行中,这些方法的潜力仍不确定。
4 结论
Tebe 是 通过临床对照试验证明对转移性 UM 具有生存优势的药物,也代表了一种新型抗癌药物。尽管生存优势明显,但仅限于 HLA-A*02:01 阳性患者,且反应率低,凸显了进一步治疗的迫切需求。尽管如此,药物开发中还是有一些有希望的方法,例如 PKC 和 c-MET 抑制剂的组合,这为转移性 UM 的更多获批带来了希望。


 医无忧服务热线:
医无忧服务热线:
